Rata de reacție chimică
Pentru a vorbi despre fezabilitatea procesului de schimbare poate fi energia sistemului Gibssa. Cu toate acestea, această valoare nu reflectă posibilitatea reală a reacției, rata și mecanismul său.
Pentru reprezentarea completă a unei reacții chimice, este necesar să se aibă cunoștințe despre ceea ce sunt modelele temporale în punerea sa în aplicare, și anume, viteza reacției chimice și mecanismul său detaliat. Mecanismul de viteză și reacția de a studia cinetica chimică - studiul procesului chimic.
Din punct de vedere al cineticii chimice, reacția poate fi clasificată în simple și complexe.
reacție simple - procese care au loc fără formarea de intermediari. Numărul de particule care iau parte la ea, acestea sunt împărțite în unimoleculare, bimolecuă trimolecular. Coliziunea mai mare de 3 numărul de particule este puțin probabilă, reacția totuși trimolecular suficient de rare și chetyrehmolekulyarnye - necunoscut. reacții complexe - procese, constând din mai multe reacții elementare.
Orice proces are loc cu viteza sa obișnuită, care poate fi determinată de schimbările care au loc într-o perioadă de timp. reacție chimică de mare viteză exprimată prin schimbarea numărului n de substanță sau substanțe obținute pe unitatea de volum V pe unitatea de timp t consumată.
În cazul în care se consumă substanța, apoi am pus semnul „-“, dacă este depozitat - „+“
La volum constant:
Unitatea de viteză de reacție mol / l · s
În general, v - o constantă și nu depinde de faptul dacă, pentru oricare dintre reactanți, urmăm.
Dependența concentrației unui reactant sau produs al timpului de reacție sunt sub forma curbei cinetice. care are forma:
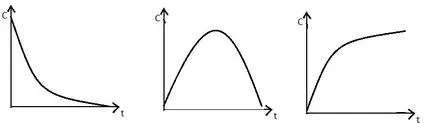
Υ se calculează din datele experimentale este mai convenabil dacă expresia de mai sus pentru a converti la următoarea expresie:
υ = - ΔC / At [mol / l · sec]

Legea acțiunii de masă. Ordinea și viteza de reacție constantă
Una dintre formulările legii acțiunii maselor este următoarea: reacție chimică omogen elementar Viteza este direct proporțională cu produsul concentrațiilor reactante.
Dacă procesul de testare este reprezentat ca:
și A + B b = Produse
viteza reacției chimice poate fi exprimată prin ecuația cinetică:
a și b - coeficienți stoichiometrice de reacție simplu,
k - constanta vitezei.
semnificația chimică a cantității k - este viteza de reacție a concentrațiilor individuale. Aceasta este, în cazul în care concentrația substanțelor A și B sunt egale cu 1, atunci υ = k.
Trebuie avut în vedere faptul că, în procese chimice complexe și coeficienții și b nu coincid cu stoechiometric.
Legea acțiunii de masă este efectuată în anumite condiții:
- Termichno reacție este activată, adică, energia termică a moleculelor.
- Concentrația reactanților este distribuit uniform.
- Proprietățile și condițiile de mediu nu se schimbă în timpul procesului.
- Proprietățile media nu ar trebui să fie afectate de k.
Prin procesele complexe ale legii acțiunii în masă nu poate fi aplicată. Acest lucru poate fi explicat prin faptul că un proces complex care constă din mai multe etape elementare, iar rata va fi determinată nu de totalul tuturor etapelor de viteză, doar una dintre cele mai lente etapă, care se numește o limitare a ratei.
Fiecare reacție are propria sa ordine. Definiți ordine privată (parțial) asupra reactivului și ordinea generală (complet). De exemplu, în ceea ce privește viteza de reacție chimică pentru procedeul
și A + B b = Produse
a - în ordine reactantului A
procese simple pentru ordinea de reacție indică numărul de specii reactive (raporturi aceleași stoichiometrice) și este un număr întreg. Pentru complex procesează comanda reacției nu coincide cu coeficienți stoichiometrice și poate fi oricare.
Definiți factorii care afectează viteza unei υ reacție chimică.
Dependența vitezei de reacție asupra concentrației reactanților
Este evident faptul că odată cu creșterea concentrațiilor reactanților, υ crește ca crește numărul de coliziuni între participarea la o substanță de proces chimic. Mai mult decât atât, este important să se ia în considerare ordinea reacției: dacă n = 1 pentru unii reactivi, rata este direct proporțională cu concentrația substanței. Dacă oricare reactant n = 2. dublarea concentrației va crește viteza de reacție în 2 2 = 4 ori, și creșterea concentrației de 3 ori pentru a accelera reacția 3 februarie = 9 ori.
Dependența vitezei de reacție la presiune
determinat Clapeyron - Mendeleev. care se referă concentrația și presiunea:
Astfel, modificarea concentrației în sistem și, prin urmare, viteza de reacție este direct dependentă de schimbarea de presiune. Această relație este relevantă în primul rând procesele care au loc implică utilizarea de gaze. De exemplu, pentru o primă reacție comandă, creșterea presiunii va determina o creștere de 2 ori a concentrației substanței este de 2 ori care își schimbă în mod necesar υ - ar fi de 2 ori mai mult.
Zavisimostskorosti suprafață reaktsiiot
În ceea ce privește reacțiile eterogene. Substanțele reacționeze rapid dacă suprafața pe care substanțele de reacție pot apărea mai. Dizolvarea substanta, reducem dimensiunile sale la dimensiunile moleculei, sporind astfel aria suprafeței. Prin urmare, procesele chimice între substanțele în stare dizolvată, lichidă sau gazoasă au o viteză mai mare decât interacțiunea dintre solidele.Zavisimostskorosti reaktsiiot natura substanței.
Este importantă structură a învelișului de electroni al atomului, tipul legătură chimică și rezistența sa în structura moleculelor substanței, puterea rețelei cristaline. Este cunoscut faptul că de sodiu este activ reacționează cu apă decât, de exemplu, staniu. Prin urmare, viteza de reacție cu apă viteză interacțiunea cu apă de sodiu staniu mai mare.Dependența vitezei de reacție la temperatură
definit de regula van't Hoff și ecuația Arrhenius. Prin creșterea temperaturii, raportăm molecule suplimentare de energie (prin aceasta crescând energia de activare), care promovează reacția. Svante Arrhenius în 1889, studiind dependența υ de temperatură, a constatat că majoritatea proceselor chimice sunt supuse ecuației:
unde k - constanta vitezei de reacție
Ea este energia de activare - minim de energie (critică) necesară pentru unitatea de reacție este J / mol
T - temperatura absolută
R - constanta de gaz, R = 8,314 J / mol · deg
A - factorul de pre-exponențială (factorul de frecvență) unitate coincide cu k. Această constantă exprimă probabilitatea ca coliziunea dintre moleculele sunt orientate astfel încât interacțiunea a fost posibilă.
Se întâmplă adesea că constanta de viteză este cunoscută la o singură temperatură T1. și atunci când este necesar k pentru a găsi unele T2 diferite de temperatură. Acest lucru este ușor de făcut, dacă luăm logaritmul ecuației Arrhenius la T1 și T2:
Scăzând a doua ecuație din prima, obținem:
La determinarea ratei reacției chimice, poate fi utilizat și ecuația Arrhenius (în cazul în care υ ecuația puterii este descrisă):
Dacă presupunem că concentrația substanțelor A și B sunt constante și logaritmi această expresie, obținem următoarele:
De asemenea, este convenabil să se folosească regula de degetul mare, care este formulat Jacob van't Hoff. creșterea temperaturii pentru fiecare 10 grade, duce la o creștere a vitezei de reacție este de 2 - 4 ori. Regula este o expresie matematică:
γ - coeficientul de temperatură, cu valori cuprinse între 2 și 4.
υT1 / υT2 = 03 februarie = 9. Aceasta înseamnă că υ a crescut cu 9 ori.
Dependența vitezei de reacție pe prezența unui catalizator
Cataliza - este orice modificare a ratei de reacție sub influența unui catalizator. Acesta poate fi pozitiv sau negativ. Esența Catalysis - generarea de catalizatori activi substrat sau reactante care implică.
Un catalizator este o substanță care accelerează în mod selectiv reacția chimică, angajându-se astfel etapa intermediară, dar regeniriruyas la capătul său (în momentul formării produselor finale). De exemplu, în mediul biochimic enzime acționează în calitate de catalizatori.
Dacă o astfel de substanță încetinește reacția chimică, se numește un inhibitor.
Efectul catalizatorului asupra vitezei de reacție se bazează pe faptul că ea schimbă EA energia de activare, sau coborârea A. sub acțiunea catalizatorului energia de activare este reprezentată schematic mai jos:
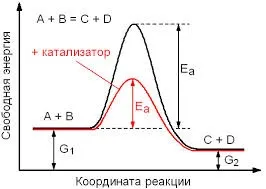
Este evident că substanțele A și B necesită o cantitate mare de energie pentru a forma produsele finale. Dar, în prezența unui catalizator pentru producerea produselor finale necesită mult mai puțină energie, deoarece scade energia de activare totală și, astfel, crește viteza de reacție. Vă atrag atenția asupra faptului că energia atât a substanțelor inițiale și finale sunt aceleași în ambele reacții.