Răspunsuri la test pe tema „halogeni“ (Gabrielyan)
PARTEA A. Teste cu posibilitatea alegerii de răspuns
1. Distribuția energetică a nivelelor de energie în atomul de fluor:
V. 2e, 7e.
2. Dintre acestea, cele mai mici elemente chimice raza atomică a atomului:
B. Fluor.
3. Dintre acestea, elementele chimice din compușii cel mai mare atom electronegativitate are:
B. Fluor.
4. Poziția elementului de brom în tabelul periodic:
W. patra perioadă de subgrupa principal din grupa VII.
5. Dintre aceste substanțe cele mai pronunțate are proprietăți oxidante:
B.Ftor.
6. clor Aspect în condiții normale:
A. sub formă gazoasă.
7. Legătura chimică în molecula de fluor:
B. covalentă nepolară.
8. O pereche de compuși cu formulele, fiecare dintre care comunică nepolare numai covalente:
V.S12 H2.
9. soluție de fluorură în apă nu pot fi preparate deoarece:
G. Fluorul reacționează cu apa.
10. Clorul reacționează cu o soluție a unei substanțe, a cărei formulă este:
B. NaBr.
PARTEA B. Ținte cu răspuns liber
11. Dați exemple de compuși de iod, în care formează o nepolar covalent, ionice și polare legături covalente. Răspunsul ilustrează o diagramă a formării legăturilor chimice.
I2: I # 804; # 776;: I # 804, # 776;:
HI H: I # 776; # 804;:
KI K- [I] +
12. Scrieți ecuația reacțiile moleculare prin care să se efectueze următoarea transformare:
Cl2 -> HK1 -> NaCl -> AgCl.
1 Să considerăm reacția în ceea ce privește WRA.
CL20 + H20 = 2H + Cl-
Cl02 + 2 * 1e = 2Cl- oxidantului
H20 - 2 * 1e = 2H + reducătorului
HCl + NaOH = NaCl + H2O
NaCl + AgNO3 = AgCl ↓ + NaNO3
13. După cum recunosc soluțiile de clorură de potasiu și nitrat de potasiu? Înregistrează ecuațiile ionice moleculare, complete și scurte.
Se adaugă nitrat de argint, in vitro, clorura de potasiu laminate precipitat alb.
KCl + AgNO3 = AgCl ↓ + KNO3
K + + Cl- + Ag + + NO3- = AgCl ↓ + K + + NO3-
Cl- + Ag + = AgCl ↓
14. halogenură în laborator preparată prin reacția cu acid sulfuric concentrat cu halogenuri metalice.
Conform schemei de reacție
NaF (T) + H2S04 (KOH4) -> NaHS04 + HF ↑
Calculați masa halogenură preparată din 2 mol de fluorură de sodiu.
n (HF) = n (NaF) = 2 mol
m (HF) = 2 mol * 20 g / mol = 40 g
Denumirea 15. Înregistrarea și formula unei substanțe care este utilizată pentru dezinfectarea apei, pânză de albire și hârtie.
clor (Cl2) și conexiunile sale.
Bleach, înălbitor: Ca (OCI) 2 • CaCl2 • Ca (OH) 2 • 2H2O
PARTEA A. Teste cu posibilitatea alegerii de răspuns
1. Distribuția energetică a nivelelor de energie ale unui atom de clor:
G. 2e, 8e, 7e.
2. Dintre acestea, cele mai mari elemente chimice raza atomică a atomului:
B. Iod.
3. Dintre acestea, elementele chimice din compușii cel mai mic atom electronegativitate are:
B. Iod.
4. Reglementarea elementului de clor în tabelul periodic:
B. a treia perioadă, subgrupa principal din grupa VII.
5. Dintre aceste substanțe proprietăți de reducere a mai pronunțate are:
B. Iod.
6. fluorul Aspect în condiții normale:
A. sub formă gazoasă.
7. Legătura chimică în molecula de iod:
B. covalentă nepolară.
8. O pereche de compuși cu formulele, fiecare dintre care comunică doar covalente polare:
B. HK1, HBr.
9. Numele unui halogen, care a fost utilizat în luptă ca substanță toxică:
G. clor.
10. Bromul nu reacționează cu substanța, formula din care:
A. NaCl (p-p).
PARTEA B. Ținte cu răspuns liber
11. Dați exemple de compuși de clor, în care formează un nepolar covalent, ionice și polare legături covalente. Răspunsul ilustrează o diagramă a formării legăturilor chimice.
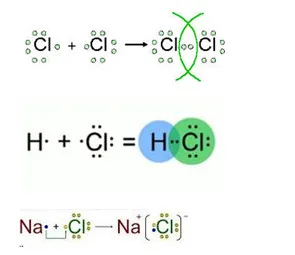
12. Scrieți ecuația reacțiile moleculare prin care să se efectueze următoarea transformare:
NaCl -> Cl2 -> CuCI2 -> AgCl.
1 Să considerăm reacția în ceea ce privește WRA.
1. 2NaCI + 2H2O -> H2 + Cl2 + 2NaOH
Anod: 2CI (-) - 2e (-) -> Cl2 (0)
Catod: 2H2O + 2e (-) -> H2 + 2OH (-)
2. Cl2 + Cu = CuCl2
CuCl2 + 2AgNO3 = 2AgCl ↓ + Cu (NO3) 2
13. După cum recunosc soluții de bromură de sodiu și nitrat de sodiu? Înregistrează ecuațiile ionice moleculare, complete și scurte.
Reacția cu nitrat de argint. In toamna vitro bromura de precipitat.
NaBr + AgNO3 = AgBr ↓ + NaNO3
Na + + Br- + Ag ++ NO3- = AgBr ↓ + Na + + NO3-
Ag + + Br- = AgBr ↓
14. halogenură în laborator preparată prin reacția cu acid sulfuric concentrat cu halogenuri metalice.
În cadrul schemei
NaI (T) + H2S04 (KOHTS) -► NaHS04 + Hl ↑
Se calculează greutatea halohidric, obținută din 1,5 mol de iodură de sodiu.
n (HI) = n (Nal) = 1,5 mol
m (HI) = 1,5mol * 127 g / mol = 190,5 g
15. Se înregistrează denumirea și simbolul compusului halogen, care este utilizat pentru calmarea sistemului nervos.
brom, Br2
PARTEA A. Teste cu posibilitatea alegerii de răspuns
1. Distribuția energetică a nivelelor de energie în atomul de brom:
V. 2e, 8e, 18e, 7e.
2. Dintre aceste substanțe chimice cea mai mare rază a atomului:
B. Iod.
3. Dintre acestea, elementele chimice din compușii cel mai mic atom electronegativitate are:
B. Iod.
4. Poziția elementului de fluor în tabelul periodic:
A. Perioada de 2, subgrupa principal al Grupului VII.
5. Dintre acești compuși exprimați de proprietăți mai mici de oxidare are:
B. Iod.
6. Aspect iod în condiții normale:
B. Solid.
7. Legătura chimică în molecula de brom:
B. covalentă nepolară.
8. O pereche de substanțe cu formulele în fiecare dintre care legătura în moleculele numai ion:
B. NaCl, KBr.
9. Proprietatea nu este caracteristic de fluor:
B. Cel mai pasiv.
10. Clorul reacționează cu substanța, formula din care:
G. H2.
PARTEA B. Ținte cu răspuns liber
11. Dați exemple de compuși cu brom, în care formează o nepolar covalente, ionice și polare legături covalente. Răspunsul ilustrează o diagramă a formării legăturilor chimice.

12. Scrieți ecuația reacțiile moleculare prin care să se efectueze următoarea transformare:
HBr -> KBr -> Br2 -> SaVg2.
2, ia în considerare reacția din punctul de vedere al WRA.
1. 2HBr + 2K = 2KBr + H2
2. 2KBr- + Cl02 = KCl- + BR02
Cl2 (0) + 2e (-) -> 2CI (-)
2Br (-) - 2e (-) -> Br2 (0)
3.
13. După cum recunosc soluții de iodură de sodiu și nitrat de sodiu? Înregistrează ecuațiile ionice moleculare, complete și scurte.
Reacția cu nitrat de argint - reacție calitativă pentru ionii de clorură, bromură și iodură. Precipitatul de iodură de argint - galben.
NaI + AgNO3 = AgI ↓ + NaNO3
Na + I- + Ag + NO3 = AgI ↓ + Na + NO3-
I- + Ag + = AgI ↓
14. halogenură în laborator preparată prin reacția cu acid sulfuric concentrat cu halogenuri metalice.
În cadrul schemei
NaBr (T) + H2S04 (KOHTS)> NaHS04 + HBr ↑
Calculați masa halogenură preparată din 0,5 moli de bromură de sodiu.
n (HBr) = n (NaBr) = 0,5 mol
m (HBr) = 0,5mol * 80 g / mol = 40 g
15. Se înregistrează denumirea și simbolul compusului halogen se adaugă la pasta de dinti pentru a preveni cariile dentare.
F2 fluor
PARTEA A. Teste cu posibilitatea alegerii de răspuns
1. Distribuția energetică a nivelelor de energie într-un atom de iod:
V. 2e, 8e, 18O, 18e, 7e.
2. Dintre aceste substanțe chimice cea mai mare rază a atomului:
B. Iod.
3. Dintre acestea, elementele chimice din compușii cel mai mic atom electronegativitate are:
B. Iod.
4. Furnizarea de elemente de iod în tabelul periodic:
G. perioada de 5-lea, subgrupul principal al grupului VII.
5. Dintre aceste substanțe proprietăți de reducere a mai pronunțate are:
B. Iod.
6. bromul Aspect în condiții normale:
B. Lichid.
7. Legătura chimică în molecula de clor:
B. covalentă nepolară.
8. O pereche de compuși cu formulele, fiecare dintre care comunică doar covalente polare:
B. HI, S02.
9. Soluția alcoolică a halogenului utilizat pentru tratamentul rănilor:
B. Iod.
10. Bromul reacționează cu substanța, formula din care:
B. H2.
PARTEA B. Ținte cu răspuns liber
11. Dați exemple de compuși cu fluor, în care formează o nepolar covalent, ionice și polare legături covalente. Răspunsul ilustrează o diagramă a formării legăturilor chimice.
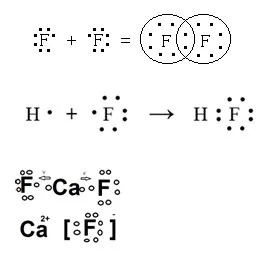
12. Scrieți un ecuații de reacție moleculare prin care transformare pot fi efectuate:
HI -> KI -> I2 -> ALI3.
2, ia în considerare reacția din punctul de vedere al WRA.
1. HI + KOH = KI + H2O
2. 2KI- + Cl02 = 2KCl- + I02
2I (-) - 2e (-) -> I2 (0)
Cl2 (0) + 2e (-) -> 2CI (-)
3. 3I2 + 2AL = 2AlI3
13. După cum recunosc soluții de bromură de sodiu și nitrat de sodiu? Înregistrează ecuațiile ionice moleculare, complete și scurte.
Reacția cu nitrat de argint - reacție calitativă pentru ionii de clorură, bromură și iodură. Precipitatul de bromură de argint -bledno galben.
NaBr + AgNO3 = AgBr ↓ + NaNO3
Na + + Br- + Ag ++ NO3- = AgBr ↓ + Na + + NO3-
Ag + + Br- = AgBr ↓
14. halogenură în laborator preparată prin reacția cu acid sulfuric concentrat cu halogenuri metalice. În cadrul schemei
NaCl (T) + H2S04 (KOHTS) -► NaHS04 + HCI ↑
Se calculează greutatea halohidric, obținută de la 3 moli de clorură de sodiu.
n (HCl) = n (NaCl) = 3 mol
m (HCl) = 3 mol * 36,5 g / mol = 109,5 g
15. Se înregistrează denumirea și simbolul compusului halogen se adaugă sarea comună pentru profilaxia bolilor tiroidiene.
iod I2