Proteine precum polielectroliți
Polyelectrolytes - DIU este compus din macromolecule care conțin grupări capabile de ionizare în soluție. Polyelectrolytes conțin un număr mare de grupe ionice ( „poli“) și soluțiile lor sunt capabile de a trece un curent electric ( „electroliți“). grupări ionice poate fi acid sau bazic și acid și bazic în același timp.
Pentru polyelectrolytes includ unele rășini și floculantilor (vezi. Punctele 6.5 și 10.7)
grupă de acid carboxilic (-COOH) cuprinde partea solubilă a amidonului și sulfo (-SO3) - partea solubilă a agar-agar. Proprietățile de bază ale polielectrolit determinat grupa amino -NH2. Proteinele sunt cele mai comune polielectroliții. În afară de acid (-COOH), de asemenea, proteinele conțin grupări bazice (-NH2) și altele. Din acest motiv, ele pot fi considerate amfoliți.
Macromoleculele proteină formată din aminoacizi (NH2-R-COOH). În reacția dintre carboxil și grupările amino sunt formate legături peptidice
O
||
-C-NH-, catene polipeptidice care formează proteine.
Dreptunghiurile închise legături peptidice și semnele „-“ și „+“ indică un suprapreț cauzată de deplasarea norului de electroni și determinarea macromolecule hidrofile.
Macromoleculele proteine, posibil diferite combinații de lanțuri de polipeptide, care sunt formate din doar 20 de aminoacizi simpli. Numărul de diferite combinații ale acestor acizi cu numărul de atomi care formează macromolecule (circa 10 3 -10 4) și un număr semnificativ de grade conformationale de libertate (februarie 10 -103). Din acest motiv, lanțul polipeptidic poate lua multe stări conformaționale microscopice, de ordinul a 10 n (n - numărul de resturi de aminoacizi, care ajunge la câteva sute), care determină varietatea de proteine.
lanțuri polipeptidice formează structura primară a proteinelor. care se referă la baza structurale covalenta a macromoleculelor și secvențe specifice de resturi de aminoacizi. Moleculara macromolecule proteice greutate poate varia de la 1,2 # 8729; 10 april până la 10 6.
Toate acestea apar in mod natural molecule proteice identice în compoziția de aminoacizi, secvențe de reziduuri acide și lungimea legăturii polipeptidic. De exemplu, hemoglobina din sânge uman este format din 574 de resturi de aminoacizi și are o greutate moleculară de 64.500.
Proteinele în starea lor naturală numite native și proprietățile lor coloidale depind de structura macromoleculară; distinge proteine globulare și structura fibrilară.
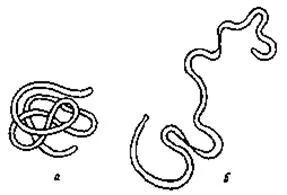
Macromolecule lanțuri polipeptidice proteină fibrilară sunt alungite de-a lungul unei singure axe. Proteinele fibrilare sunt în general insolubile în apă. Figura 20.1 prezintă structura fibrilară a proteinei - par keratina. Macromolecule keratina rana pe unul pe altul ca o muchie de cuțit. În organism, proteinele fibrilare efectua de multe ori funcții mecanice. Astfel, de exemplu, proteinele fibroase sunt colagenul și gelatina - părți componente ale pielii și ale tendoanelor, precum și miozină, care face parte din mușchi.
Proteinele sunt capabile de formarea globulelor numite globular (fig. 20.2, a). proteine globulare sunt caracterizate de forma specifică de pliere a lanțului polipeptidic în spațiu. Proprietățile coloid-chimice ale proteinelor globulare în manifest într-o măsură mai mare decât fibrilar. Cele mai multe dintre polare centre hidrofile [vezi. formula (20.1)] proteină macromoleculară este în afara globulelor, iar acest lucru determină hydrophilicity lor, solubilitatea în apă bună și reactivitate ridicată.
proteine globulare găsite în sânge, limfă, citoplasmă celulelor. Pentru acest grup de proteine includ albumine și globuline albus de ou, lapte, ser sanguin, suc gastric, pepsina și altele.
20.1. Structura macromoleculei fibrilară proteină keratin
Conform conceptului de organizare structurală și funcțională a proteinei macromolecule native structura tridimensională a macromoleculei proteinei este complet determinată de secvența de aminoacizi corespunde cu energia internă minimă, și în toate etapele lanțului proteic de coagulare spontană predomină interacțiunile intramoleculare ale atomilor nelegați ai interacțiunilor intermoleculare; în conformația nativă a macromoleculei de proteine trebuie să accepte interacțiunile intramoleculare ale atomilor nelegați.
interacțiunile intramoleculare, care sunt realizate prin legături de hidrogen, van der Waals și forțe electrostatice pot fi scurt, mediu și rază lungă. definesc în apropierea posibilitățile conformationale minime din cadrul fiecărui rest de aminoacid, mediu - combinarea reziduurilor conformaționale cele mai favorabile din zonele locale ale lanțului de proteine și interacțiunile îndepărtate sunt reduse pentru a forma între toate porțiunile proteinei stabilizatoare contactelor circuitului.
În organizarea globulelor de proteine interacțiuni intramoleculare esențiale sunt hidrofobe (a se vedea. Secțiunea 5.5). Catenele laterale de hidrocarburi nu sunt resturile de acid, de preferință, sunt contactate unul cu celălalt și nu cu moleculele de apă polare. Pe de altă parte, lanțul lateral preferă să interacționeze cu apă. Ca rezultat, lanțul proteic se poate plia în Globula, astfel încât resturile nepolare prin interacțiuni hidrofobe vor fi în interiorul macromoleculei și reziduurile polare vor fi amplasate pe suprafețele globulă în contact cu apa.
În plus față de proteină simplă constând din resturi de aminoacizi, sunt proteine complexe care cuprind diferite grupuri de atomi. Pentru proteinele complexe includ hemoglobina, care include complexul zhelezoporfirinovy; glicoproteine care conțin molecule de hidrocarburi; nucleoproteine care conțin acid nucleic, precum și lipoproteine, care includ molecule de grăsimi și steroizi.
In plus fata de proteinele biologice Navy sunt acizi nucleici se găsesc în toate tipurile de materie vie. reziduuri acide fosforice incluse în macromolecula de acid nucleic, cauza proprietăților lor, ca polielectroliții acide. De asemenea, reziduurile de acid fosforic, acidul nucleic include și alte grupuri de molecule, în special zaharide peptozanovyh.
acidul dezoxiribonucleic (ADN) conține deoxiriboză. ADN-ul împreună cu acidul ribonucleic (ARN) din organism viu îndeplinește o funcție biologică importantă: definește programele ereditate și sinteza proteinelor.
În cazul în care capacitatea inerentă de proteine pentru auto-organizare este principiul activ al vieții, ADN-ul acționează ca un potențial început. Sinteza proteinelor din organism are loc în conformitate cu codul genetic inerent în structura acizilor nucleici.
Proteine - o creație unică a organismelor vii. Ca produse ale vieții lor, ele oferă posibilitatea existenței și dezvoltarea organismului.