Proprietățile soluțiilor
Soluțiile ocupă o poziție intermediară între amestecurile mecanice și chimice ale compușilor. soluții și căldură Uniformitatea generație la dizolvarea anumitor substanțe le face compuși chimici similari. Spre deosebire de soluțiile de compuși chimici este faptul că compoziția soluției poate varia în culoarele largi.
În plus, proprietățile soluției poate determina proprietățile componentelor individuale, care nu se observă în cazul unui compus chimic.
Presiunea de vapori deasupra soluției
Daylight substanțe moleculare din lichid la vapori se numește evaporare. Moleculele de zi ale substanței din starea de vapori la nazyvaetsyakondensatsiey lichid.
Dacă lichidul este stocat într-un vas închis, echilibrul este atins atunci când viteza de evaporare a lichidului este egală cu rata de condensare a aburului.
Presiunea exercitată de vapori în echilibru cu lichidul, se numește presiunea vaporilor saturati din lichid. Această presiune maximă a vaporilor care dezvoltă lichid. Presiunea de vapori saturați depinde de natura fluidului și temperatura și nu depinde de cantitatea de lichid.
Suprafața soluției, spre deosebire de suprafața solventului pur, parțial ocupat de moleculele de solut. Prin urmare, numărul de molecule de solvent se evaporă în unitatea de timp, cu suprafața unității soluție One este mai mică decât o O unitate a suprafeței de solvent. Prin urmare, la aceeași temperatură, presiunea vaporilor deasupra soluției va fi întotdeauna sub presiunea de vapori a solventului.
Cantitativ, această relație este exprimată prin legea lui Raoult F. „Soluțiile ideale la o valoare constantă a temperaturii de reducere a vaporilor de solvenți deasupra soluției presiunea relativă este egală cu fracția molară a solutului.“
P0 - presiunea de vapori a solventului pur,
P - presiunea vaporilor de deasupra soluției.
Soluția ideală - o soluție în care forțele intermoleculare sunt egale. Atunci când substanțele A și B formează o soluție ideală, forțele dintre moleculele A ... A ... A și B ... B sunt egale.
Din legea lui Raoult că vaporii peste amestecul de lichide A și B conține ambele substanțe, iar presiunea vaporilor saturați fiecărei substanțe în amestec este egal cu produsul din fracția molară a substanței la presiunea de vapori saturați de mai sus substanță pură, adică.:
RA - presiunea vaporilor de deasupra soluției de substanță A,
NA - fracție molară de compus A rasvore,
P 0 A - presiunea vaporilor deasupra substanței O substanță pură.
Punctul de fierbere și soluția punctului de congelare (cristalizare)
Punctul de congelare (cristalizare) a lichidului - este temperatura la care presiunea de vapori saturați de lichid este presiunea de vapori saturați de cristale.
Deoarece, în conformitate cu legea lui Raoult, F., presiunea vaporilor de mai sus soluție materia non-volatilă sub presiunea de vapori a solventului pur, prin urmare, la aceeași presiune externă a soluției deasupra punctului de fierbere al punctului de fierbere a solventului pur și congelare temperatura soluției sub punctul de îngheț al solventului pur.
Cantitativ, această dependență este stabilită legea F. Raoult „Ridicarea sau coborârea temperaturii de fierbere a punctului de congelare al unei soluții ideale este direct proporțională cu concentrația molal solute“.
A se vedea - concentrația molal a soluției, mol / kg
E - ebuleoskopicheskaya deg constantă / mol,
Prin - constanta cryoscopic, K / mol.
E, K și arată punctul de fierbere elevație și punctul de îngheț depresiunea dintr-o soluție în care 1 kg de solvent dizolvat 1 mol de substanță.
Exemplul 1. Apa E = 0,52 grade / mol, K = 1,86 grade / mol.
Deci, atunci când se dizolvă în 1000 g apă 342 g de zahăr (C12 H22 O11) și 46 g de etanol (C2 H5 OH), temperatura fiecărei soluții a fost freeze 0 scade la 1,86.
De exemplu: pentru a determina punctul de congelare de 40% în greutate. solvent apos, glicerol (C3 H8 O3). 100 g dintr-o soluție formată din 40 g de glicerină și 60 g de apă. Astfel, 1000 g de apă (solvent) a conținut 666 g de glicerol. Greutatea moleculară a C3 H8 O3 egală cu 92 concentrație molal a soluției 666/92 = 7,24 moli / kg
A: Punctul de congelare al unei soluții de glicerină apoasă 40% - 13,5 0 C.
Exemplul 2. Soluție conținând 11,04 g de glicerină în 800 g de apă, cristalizeaza la - 0,279 0 C. Se calculează greutatea mol de glicerină.
Soluție: apă pură a temperaturii de cristalizare a 0 0 C, reducând astfel temperatura de cristalizare = At 0- (-0,279 0) 0,279 = 0. glitserinam Greutate (g) 1000 g de apă,
m = 11,04 * 1000/800 = 13,8
ecuație valoare substitut min
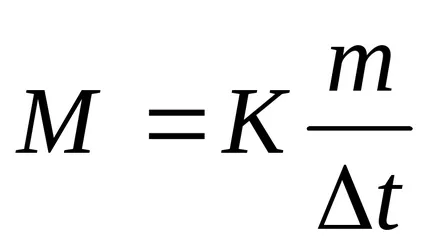
apoi masa molară a glicerină
M = 13,8 * 1,86 / 0,279 = 92 g / mol.
Măsurătorile de temperatură de fierbere și soluțiile de congelare ebullioskopicheskie pe bază și metode de determinare a cryoscopic substanțe cu greutate moleculară. Când se folosește această formulă:
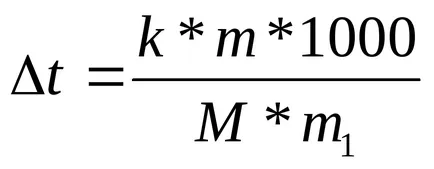
K - sau ebuleoskopicheskaya constant cryoscopic;
MI respectiv M masa solutului și masa sa molară;
m1 - masa solventului.