Produse chimice de etilenă și derivați ai săi în sinteze organice industriale, abstract
oxid de etilenă și sinteze bazate pe ea ...........................................................................
Omologii etilena ........................................................................ Sinteze ..
Bibliografie ............ .. .......................................................
Etilena a fost mai întâi obținut prin chimist german Johann Becher in 1680, sub acțiunea uleiului de vitriol în spiritul vinului. Inițial, a fost identificat cu „aer inflamabile“, adică cu hidrogen. Mai târziu, în 1795 godu etilenă primit în mod similar chimiști olandeze Deyman, Potts van Trustvik Bond și Lauerenburg și descris sub numele de „maslorodnogo gaz“, așa cum a constatat capacitatea de etilenă pentru a atașa clor pentru a forma un lichid uleios - diclorura de etilenă ( „ulei olandeză chimiști „).
Studiul proprietăților de etilenă și derivații și omologii săi au început cu secolul al XIX-lea la mijlocul. Începutul utilizării practice a acestor compuși pune studii clasice AM Butlerov și studenții săi în domeniul compușilor nesaturați și teoria Butlerov special creată a structurii chimice. In 1860, el a primit o acțiune de etilenă pe iodură de cupru, metilen, etilen stabilind formula structurală.
Etilena este un gaz incolor, cu un miros slab, abia vizibile. Este slab solubil în apă (la 0 ° C, în 100 g de apă se dizolvă 25,6 ml de etilenă), flacără luminoasă arde, formează amestecuri explozive cu aerul. Mai puțin stabil termic decât metanul. Deja la temperaturi de peste 350 ° C, parțială de etilenă se descompune în metan și acetilena:
La o temperatură de aproximativ 1200 ° C pentru a se disocieze în principal, acetilenă și hidrogen;
În sectorul gazelor naturale (cu excepția vulcanică) etilena nu este găsit. Acesta este format prin descompunerea pirogene multor compuși naturali care conțin substanțe organice.
Procedeul de piroliză pentru prepararea etilenei se realizează în cuptoare de diferite dispozitive, prin trecerea hidrocarburilor gazoase sau vapori lor, în prezența catalizatorilor, la o temperatură de 760-780 ° C utilizate în mod obișnuit de tip tub cuptor. Etilena poate fi, de asemenea, obținută prin dehidrogenarea etanului:
și hidrogenarea atentă a acetilenei:
Pentru etilenă și omologi din piroliza materiei prime etan utilizat, propan, butan conținut în liber de petrol, gaze termică și cracare catalitică a gazelor, precum și hidrocarburi lichide: nizkoaktanovye benzină naturală și cursa legroinovye fracțiune de ulei-benzină directă.
Performanta cuptoarele existente pentru piroliza hidrocarburilor este 3,5-4 tone de materie primă pe oră. cuptor construcție nou proiectat pentru prelucrarea materiei prime 7-10t pe oră.
În anumite condiții de benzină de piroliză în prepararea 1t etilenă pot fi alocate în mod simultan: propilenă - 0,65t; izobutilenă - 0,11t; n-butene - 0,11t, divinil - 0,12t; benzen - toluen și 0,165t - 0,08t, a căror utilizare se va îmbunătăți în mod semnificativ indicatorii tehnico-economici ai plantelor petrochimice. Preparat din etilenă de peste 200 de compuși, dintre care cele mai importante sunt clorura de etil, 1,2-dicloretan, cloretanol, etilen oxid, dioxan, etilen glicol, etilen glicol eter etilic, eter uksusnoglikolevy, dietilen glicol, etilamina, etanolamina, dietanolamina, trietanolamina.
Halogenarea etilenei.
reacția convențională între hidrocarburi nesaturate și halogeni este adăugarea de atomi de halogen în locul dublei legături pentru a forma cu un număr par de atomi de halogen de halogen. Cu toate acestea, olefine cu lanțuri ramificate, și la temperaturi ridicate și la olefine cu structura veniturilor normale halogenare mai dificil de a forma și policloruri monogalogenoproizvodnyh nesaturate.
Activitate reacții de adiție cu halogen scade odată cu creșterea greutății moleculare. Fluorul reacționează energic, reacție de adiție clorul are loc mult mai lent.
La început, clorurarea etilenei obținut dicloretan:
Cu toate acestea, clorurarea etilenei poate merge mai departe, rezultând într-un tricloretan și tetracloretan. Dintre aceste produse crește odată cu creșterea temperaturii de reacție. Pentru reacția de substituție a lanțului de inhibare la clorurarea etilenei și a procesului de dicloretan mai pure se realizează la temperaturi scăzute și în prezența unor mici cantități de clorură ferică și O2.
Trebuie remarcat faptul că EV Alekseevskii în 1928, stabilesc că prin trecerea unui amestec de etilenă și clor pe cărbune, la temperatura de 120 ° C dicloretan pur se obține cu un randament de 80% din cel teoretic.
Procesul de preparare a dicloretan prin clorurarea etilenei în industrie se realizează într-un reactor cu tanc sau bule de tip turn agitat. Uscată complet în prealabil, pentru a evita coroziunea echipamentului, clor și etilena, cu acesta din urmă un ușor exces (5-10%) sunt alimentate separat la partea inferioară și reaktora1 barbotat printr-un strat de dicloretan.
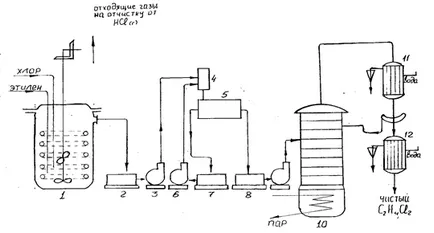
Excesul se scurge într-un dicloretan colectare 2. Gaze conținând perechea dicloretan, acid clorhidric, etilena nereacționată sunt furnizate vymorazhivatel pentru extragerea dicloretan, iar gazele rămase sunt spălate cu apă pentru a îndepărta clorura, iar apoi de ieșire din sistem. Din colecția de pompă brută 2-dicloretan 3 este direcționată către amestecătorul 4 unde acid clorhidric dizolvat este neutralizat de hidroxid de sodiu 5-10%. Apoi azeotrop dicloretan-apă se îndepărtează prin distilare la 72 ° C într-o coloană de uscare azeotropică, nu se arată în diagrama, și pentru excluderea tricloretan și a altor impurități aduse în coloana de distilare 10.
Procedeul se realizează în dicloretan lichid, care se dizolvă clor și etilena și asigură îndepărtarea căldurii dorită din zona de reacție. circulație prin dicloretanul schimbător de căldură extern permite reacția cu un randament bun, la o temperatură de 30-40 ° C
Dicloroetan a primit aplicarea practică largă ca solvent neinflamabil la extracția grăsimilor și sinteza acestor substanțe chimice valoroase ca etilenglicol și esterii săi, etilendiamina, dibenzil, clorura de vinil, cauciuc sintetic polisulfură (Thiokol) și altele. Dicloroetanul este folosit pentru combaterea dăunătorilor / x (fumigație sau fumigație).
Se dicloretan acid clorhidric ușor scindează, transformându-se în clorură de vinil:
Producerea acestui monomer este important pentru industrie și pusă în aplicare prin alte metode. Când se formează clorurarea etilenei, la o temperatură de 430 ° C clorură de vinil:
Un dezavantaj serios al metodei de obținere a soluțiilor diclorura de etilenă este dificultatea de a separa sărurilor din proces și distilarea etilenglicolului uparki vid.
Cel mai convenabil mod de a obține hidratarea etilenei este oxid de etilenă. Acesta este de obicei realizată în prezența unor cantități mici (0,05%) de acid sulfuric drept catalizator. Amestecul a fost încălzit într-o autoclavă la 100 ° C timp de două ore. Se obține etilenglicol foarte pură, ca soluție de 25%.
Etilen glicol are multe utilizări. Este utilizat în prepararea de antigel folosit pentru răcirea motoarelor de mașini și avioane, în loc de chillere saramura, etc. Agenții antigel sunt folosite pentru a proteja elementele de dejivrare (planul elicei). Glycol este un plastifiant comun pentru diferite adezivi. Împreună cu glicerină este folosit ca emolient în industria de imprimare.
Deoarece etilenglicol este preparat, mai multe substanțe care au o mare valoare practică, de exemplu dinitroetilenglikol, esteri cu acizi organici, poliglicoli, etc.
Oxidul de etilenă reacționează puternic cu amoniac, oferind diferite etanolamine, care și-au găsit aplicarea practică.
1. monoetanolamină H2N-CH2-CH2-OH - gros lichid siropos, foarte higroscopic care au exprimat puternic proprietățile de bază.
2. Diethanolamine NH- (CH2-CH2-OH) 2 - și fumans ușor delicvescente în cristale de aer umed, cu un punct de topire de 28 ° C
3. Trietanolamina N- (CH2-CH2-OH) 3 - grele, lichid vâscos, întunecare rapid în aer. Se absoarbe umezeala și dioxidul de carbon.
Trietanolamina, dietanolamina, și parțial folosi
extragere de dioxid de carbon și hidrogen sulfurat din gazele industriale, cum ar fi sus curat de petrol sau gaze naturale. Ele sunt utilizate pe scară largă ca bază în fabricarea săpunului.
Omologii Sinteza Etilena
În jurul Omologii de etilenă - propilenă și butenele - mai activ chimic decât etilena. Reacțiile lor sunt variate și apar mai ușor, și hidrocarburi de pornire este folosită în sinteza organică industrială.
Alkirirovanie benzen cu propilenă va izopropilbenzenul (cumen), care a fost preparat prin oxidarea fenol și acetonă. Când propilena hidratare formează alcool izopropilic. Procedeul se realizează în coloane continuu, la o temperatură de 40-50 ° C folosind acid sulfuric 80-85% sau în prezența catalizatorilor lichizi sau solizi (de exemplu redus de oxid de tungsten pe silice) - drepte
Alcoolul izopropilic este utilizat pentru a se obține acetonă, anhidridă acetică, diizopropileter, peroxid de hidrogen, în industria parfumurilor, și, de asemenea, ca solvent.
Clorinarea, urmată de tratarea cu propilenă hloroproizvodnyh este acum una dintre metodele industriale pentru producerea de glicerol. La temperaturi ridicate (360-400 ° C), în prezența unui anumit catalizator (cărbune activat) sunt înlocuiți cu atomi de hidrogen din gruparea metil din propilenă și clor la clorura de alil se obține:
Industria de asemenea efectuată fabricarea acroleina din adăugarea de glicerol la aceasta de peroxid de hidrogen, urmată de reducerea glyceraldehyde.
Direcția principală în utilizarea n-butenă este de dehidrogenare de a produce butadienă - 1,3 (divinii), alchilare, hidratare și izomerizarea alcoolului butilic la izobutilenă.
Producerea de butadienă din n-butan și n-butene poate fi efectuată în două etape sau într-o singură etapă. Dehidrogenarea n-butan - endotermic:
Prin proces în două etape pentru producerea materiilor prime - fracția butanului este supus în prealabil la distilare și alimentat în prima etapă a procesului - dehidrogenarea n-butan la butenă, care se efectuează la t ° = 530-600 ° C la catalizator alyumohromovom activat cu hidroxid de potasiu și oxizi metalici. În acest scop, reactoarele tubulare sunt utilizate cu reactoarele cu pat fix și se deplasează, precum și un aparat cu pat fluidizat cu catalizator pulverizat. După răcire, comprimarea și purificarea produselor rezultate separate butenele fracție conținând care este direcționată către a doua etapă - în reactor adiabatic, în interiorul căruia există un grilaj cu patul de catalizator. În acest caz, du-te la următoarele reacții
Pentru a izola divinil pur aplica metode fizice și chimice, dintre care pot fi menționate de distilare extractivă și absorbția unei soluții apoase amoniacale de acetat de cupru (chemisorption). butenele nereacționate, a revenit la dehidrogenarea.
Pentru butanolilor privind fracția de butan-butenă, separate de cracare gaz - proces sunt acidul sulfuric. Aplicarea soluțiilor de acid clorhidric de concentrații diferite (55-80%), este recuperat dintr-un amestec care conține butani, și toate cele trei butilenă izomeric: primul izobutilenă ca izomerul mai activ, și apoi celelalte Butilene ca alcoolii secundari și terțiari corespunzători. Curățarea alcool produs prin distilare.
Izomerizarea la izobutilenă prin trecerea n-butenă prin aparatul de livrare la t ° = 300 ° C, în prezența unui catalizator acid fosforic imprimat pe samotei. Izobutilena are o activitate ridicată și a fost aplicată cu succes în industrie pentru sinteza izooctan poliizobutilene, pentru butilkauchika, unele substanțe aromatice (mosc artificial) și în mai multe alte industrii.
sursă mai serioasă pentru producerea izobutilenei este butene de cracare motorină și piroliză. Direct din izobutilenă aceste gaze pot fi recuperate prin distilare
½ ½ ½ ½
Alchilarea cu olefine este utilizat în industrie într-o scară foarte mare. Astfel, se obține etilbenzen și, pe bază de stiren, alchil fenoli și detergenți. Ca catalizatorii utilizați acizii minerali, cloruri metalice, fluorura sulfonic, bor și altele. De exemplu, prin reacția fenolului și izobutilenei, în prezența acidului sulfuric a dat butilfenol terțiară, este folosit ca intermediar în producerea de rășini fenol-formaldehidice, care sunt solubile în uleiuri precum și pentru producția de bactericide inhibitori, korezina (cauciuc sintetic emolient).
Polimerizarea olefinelor.
reacția Polimerizarea a compusului numit împreună un număr mare de molecule din aceeași substanță (monomer) la o moleculă mare (polimer). Această conexiune se datorează pentru a elibera valențele la legături duble pauză.
Compoziția chimică a compusului moleculară mare format este aceeași cu cea a monomerului de pornire.
polirizuetsya de etilenă cu mare dificultate de reacție:
Lista literaturii utilizate.
1. Valakin VP „Obținerea alcoolului etilic sintetic“
București, Editura „Chimie“ 1976.
2. "Scurt chimice Enciclopedia", T5,
editura „Enciclopedia sovietică“, 1967.
3. "General Organic Chemistry", ed. NK Kochetkov, T1
București, Editura „Chimia“ 1981.
4. AV Stepanov „Etilenă Manufacturing“
Kiev, editura "Naukova Dumka", 1973
5. Ugriumov PG Averbuh AY „Sinteza organică în industrie“
București, Editura "Iluminare", 1964.