Procesele circulare (cicluri)
Procesul prin care sistemul, care trece printr-o serie de state, se întoarce la starea inițială se numește ciclu circular sau proces. Diagrama de proces este descris ciclul închis (figura 7) a curbei.
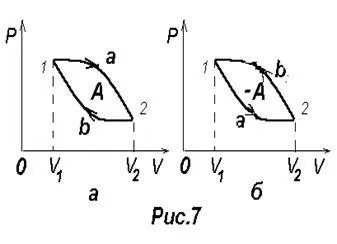
Ciclul poate fi divizat în procesul de expansiune și contracția 2-1 1-2. extinderea de lucru al care este determinată de zona din figura 1 1a2V2 V1 este pozitiv, deoarece dV> 0. munca de compresie care este determinată de zona din figura 2 2b1V1 V2 este negativ, deoarece dV <0. Следовательно, работа, совершаемая газом за цикл определяется площадью,
acoperit de o curbă închisă.
În cazul în care ciclul de lucru mecanic pozitiv (veniturile ciclu în sensul acelor de ceasornic), este numit direct (Figura 7, A). În cazul în care ciclul de lucru mecanic negativ efectuate (veniturile ciclu contrar acelor de ceasornic), se numește inversa (Figura 7 b). În cazul corpului exterior ciclu invers efectua lucru mecanic pozitiv pe gaz - lucrările de comprimare a gazului ¢ A. Gazul, în acest caz, nu ¢ negativ de lucru A = -A.
Ciclul direct utilizat în motoarele termice - motoare care funcționează în mod periodic se angajează operațiune prin primirea de căldură din exterior.
Ciclul Reverse utilizat în frigidere - instalațiile existente periodic în care, datorită funcționării forțelor externe, căldura este transferată corpului la o temperatură mai ridicată.
Ca urmare, procesul circular, sistemul revine la starea inițială și, prin urmare, schimbarea totală a energiei interne a DU zero, gaz. Prin urmare, PNT (4) pentru procesul ciclic: Q = DU + A = A. și anume munca efectuată pe ciclu este egal cu cantitatea de căldură primită din exterior. Cu toate acestea, ca urmare a procesului circular motor termic cum să obțină și să dea, prin urmare, A = Q1 -Q2. în cazul în care Q1 - cantitatea de căldură primită de către sistem, Q2 - sistemul dat de căldură kolichetvo. Rata de eficiență pentru procesul ciclic
proces numit termodinamic reversibil în cazul în care poate avea loc atât în direcția înainte și înapoi și, astfel, sistemul revine la starea inițială și în mediu și în acest sistem nu există nici o schimbare. De exemplu, neamortizate vibrații. Rețineți că procesele de echilibru este, de asemenea, numit reversibil.
Orice proces care nu îndeplinește aceste condiții se numește ireversibil. (De notat că toate procesele însoțite de frecare, sunt ireversibile).
Ciclul Carnot este reprezentată în Figura 8, în care expansiunea izotermă și compresia sunt date de curbele 1-2 și 3-4, expansiunea adiabatică și contracție - curbele 2-3 și 4-1.
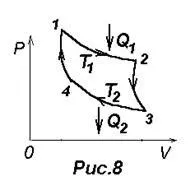
Conform (23) randamentul ciclului Carnot, h = A / Q = (Q1 -Q2) / Q1 = 1- Q2 / Q1. unde Q1 - cantitatea de căldură produsă de încălzitor de gaz, temperatura T1. Q2 - răcitor kolichetvo gaz dat caldura, temperatura T2. Carnot a arătat că, pentru acest ciclu este h = (Q1 -Q2) / Q1 = (T1 -T2) / T1 = 1, T2 / T1. (24), adică Eficiența este determinată numai de temperaturi ale încălzitorului și frigider. Carnot presupus că acest rezultat este valabil pentru orice sisteme termodinamice.
Ciclul Carnot Reverse este baza pentru acțiunea pompelor de căldură. Pompele de căldură au nevoie de energie termică cât mai mult posibil pentru a obține un corp fierbinte, cum ar fi sistemul de încălzire. Cea mai mare parte a energiei este luat din mediul de temperatură scăzută și o parte inferioară - se obține prin lucru mecanic, produs, de exemplu un compresor.
4.10.1. Entropia in termodinamica
Atunci când studiul PNT () menționat. că dU este o diferențială totală (cunoscut din matematică că dU diferențială este completă dacă integrală este independentă de calea de integrare, în special, integrala de-a lungul unui traseu închis sau bucla L = 0) și dQ dA și diferențialele nu sunt complete.
Matematicii este, de asemenea cunoscut faptul că valoarea cu care este necesar să se înmulțească o expresie pentru un diferential complet face, se numește factor integrator. În termodinamică, se dovedește că pentru un proces reversibil astfel factor integrator este de 1 / T și când dQ / T va fi diferențial total al unora încă necunoscute pentru noi starea sistemului funcției S, adică dQ / T = dS. (25)
Astfel determinată funcție de stare S entropia termodinamică a apelului sistem, acesta se măsoară în J / K. De la (25), vom vedea că și dQ dS sunt de același semn. Acest lucru vă permite să schimbați natura entropiei de a judeca direcția procesului de transfer de căldură. Conceptul de entropie a fost introdus în 1865 de către Clausius.
POT (8) pentru o masă m arbitrar gaz ideal cu formula U = (i / 2) nRT = NCV T. CV = (i / 2) R, PV = nRT (n = m / M - numărul de moli) și ia forma entropia diferențială deplină
Deoarece gaz ideal PV greutate constantă / T = const.
LNP + lnV -lnT = const. și d LNP + d lnV -d LNT = 0 și ecuația (26) poate fi scrisă în două forme echivalente el
În cazul în care sistemul trece de la starea 1, caracterizat prin parametrii P1. V1. T1. în starea 2, caracterizată prin P2 parametri. V2. T2. în funcție de schimbarea entropiei (26) - (28) DS = S2 -S1 = = n [CV ln (T2 / T1) + R ln (V2 / V1)] =
și anume într-adevăr, dS = dQ / T este starea totală diferențială funcția S - entropie.
Deoarece pentru un proces adiabatic dQ = Tds = 0. apoi, în consecință, Ds = 0 și S = const. Astfel, un proces adiabatic reversibil este un proces isentropic.
Formulele (26) - (29) face posibilă construirea unei diagrame termodinamice T-S. A se vedea. Figura 9. Să punctul O reprezintă starea inițială a unui gaz ideal, atunci
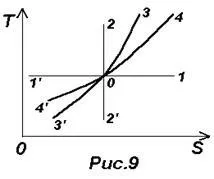
proces izobară descris linia 4-4 ¢. de prelungire a pus isochore ¢ 3-3 (0-4 - încălzire și expansiune, 0-4 ¢ - răcire și de compresie).
Astfel, entropia S poate fi considerată ca exact același parametru ca și trei alt parametru P, V, T. La fel ca o ecuație ideală de gaz PV stare = nRT posibil de a exprima, de exemplu, T, prin intermediul altor parametri P și V. și expresia ( 29) face posibilă exprimarea S prin alți parametri de sistem P. V și T.
4.10.2. Entropia unui punct de vedere cinetic. A treia lege a termodinamicii
Entropia, termodinamică a introdus aici, a fost folosit cu succes în calculele din termodinamică.
Când lichidul se întărește, moleculele din cristal ocupă poziția bine definită în raport cu celălalt, astfel încât tulburarea scade brusc. Prin urmare, căldura eliberată în timpul solidificare și, de asemenea, entropia scade brusc. La zero absolut mișcarea termică se oprește complet, deci dereglare este de asemenea zero. În acest sens, entropia tuturor substanțelor la T = 0 este luată egală cu zero.
Adoptarea: entropia tuturor corpurilor în echilibru tinde la zero, deoarece temperatura de zero grade Kelvin apropie, adică numita a treia lege a termodinamicii sau teorema lui Nernst-Plank (1906 1910).
Noțiunea de entropie ca o măsură de dezordine într-un sistem bine descrie dependența sa nu numai la temperatură, ci și asupra mărimii și a altor parametri ai sistemului.
4.10.3. Entropia în fizica statistică echilibru
Sensul mai profund al entropiei este revelat în fizica statistică: entropia asociată cu probabilitatea termodinamică a stării sistemului. Termodinamic probabilitate W sistemul de stat - este numărul de moduri în care pot fi puse în aplicare o anumită stare a sistemului sau numărul de microstările macroscopice efectuarea acestei macrostări. Prin definiție W³ 1. adică probabilitatea termodinamică nu este veroyanost P în sens matematic (P £ 1).
De exemplu, un mol de macrostări oxigen corespunzător fizic P = 1 atmosferă, și T = 300 K poate fi efectuată număr microstările W =. Imaginați-vă acest număr este destul de imposibil.
Boltzmann în 1872 se arată că entropia sistemului și probabilitatea termodinamică legate de următoarea formulă
unde k - este constanta lui Boltzmann. Pentru exemplul de mai sus S = 200 J / K.