Prima lege a termodinamicii și aplicarea sa în diverse procese
Cantitatea de căldură transmisă la un sistem termodinamic, este cheltuit pe modificarea energiei sale interne și pentru a face sistemul să funcționeze împotriva forțelor externe.
Dacă în loc de funcționare a sistemului A la organismele externe intră funcționarea forțelor externe A „(A = -A“), prima lege a termodinamicii poate fi rescrisă ca:
Schimbarea în energie internă a unui sistem termodinamic este egală cu cantitatea muncii efectuate asupra sistemului de forțe externe, iar cantitatea de căldură transferată către sistemul în procesul de schimb de căldură.
Prima lege a termodinamicii este o generalizare a legii de conservare a energiei pentru procesele mecanice și termice. De exemplu, ia în considerare procesul de inhibare a barei pe suprafața orizontală prin forța de frecare. viteza bar scade, energia mecanică a „dispărut“. Dar, în timp ce suprafața de frecare (suprafața șinei și orizontală) sunt încălzite, adică, Energia mecanică este transformată în intern.
Aplicarea primei legi a diferitelor procese termice
Dislocarea este neschimbat: V = const. De aceea, = 0 și Av A = -A „= 0, adică, nici un lucru mecanic nu se face. Prima lege a termodinamicii ar fi:
Atunci când procesul de izocoră toată energia transmisă la gaz prin schimb de căldură, în întregime consumată pentru a crește energia internă.
Temperatura gazului nu se schimbă: Τ = const. Prin urmare, AT = 0 și = 0. AU Prima lege a termodinamicii ar avea forma:
Atunci când procesul de izoterma toată energia transmisă la gaz prin schimb de căldură, este de a realiza gazul de lucru.
Presiunea nu se schimba: p = const. Gazul expansiune funcționează Α = p⋅ΔV și încălzit, adică își schimbă energia internă.
Prima lege a termodinamicii este forma:
În cazul în care procesul de izobară cantitatea de căldură transmisă la un sistem termodinamic, este cheltuit pe modificarea energiei sale interne și pentru a face sistemul să funcționeze împotriva forțelor externe.
Acesta este un proces în care nu are loc schimbul de căldură cu mediul înconjurător, adică, Q = 0
Cantitatea de căldură la primirea care temperatura corpului crește cu un grad, numit de căldură. Conform acestei definiții
Capacitatea de încălzire diferă în funcție de condițiile în care are loc corpul de încălzire - la volum constant sau o presiune constantă.
În cazul în care corpul de încălzire are loc la volum constant, adică. E. DV = 0, lucrarea este zero. În acest caz, căldura transmisă organismului este doar o schimbare în energia internă, dq = dE. și în acest caz, capacitatea termică egală cu variația energiei interne atunci când temperatura se modifică cu 1 K, t. e.
În ceea ce privește gaz, atunci.
Această formulă determină capacitatea calorică a 1 mol de gaz ideal, denumit molar. Când gaz încălzit la presiune constantă variază volumul său, a raportat căldura corpului este nu numai pentru a crește energia internă, dar, de asemenea, pentru a efectua munca, adică, dQ = dE + PDV. Căldura specifică la presiune constantă.
Luând în considerare acest lucru, vom găsi
Raportul este o caracteristică valoare pentru fiecare gaz și determină numărul de grade de libertate a moleculelor de gaz. Măsurarea capacității calorice a corpului este astfel o metodă de măsurare directă a caracteristicilor microscopice ale moleculelor sale constitutive.
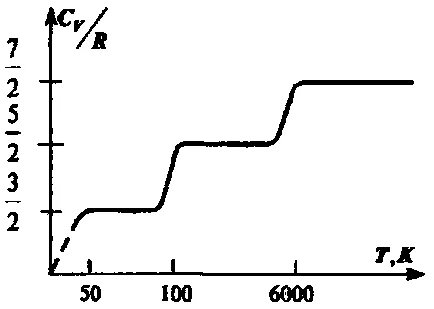
Formulele de capacitate ideală de căldură cu gaz aproximativ descrie drept un experiment în care, în principal, pentru gaze monoatomice. În conformitate cu formulele derivate de mai sus, capacitatea termică nu depinde de temperatură. De fapt, există o imagine prezentată în Fig. derivat empiric pentru un gaz de hidrogen diatomic. La stația 1 gazul se comportă ca un sistem de particule având un grad de libertate de translație, în zona 2 este condus mișcarea asociată cu o rotație de grade de libertate și, în final, în zona 3 există două grade de libertate de vibrație. Pașii din curba în bună concordanță cu formula (2.35), dar între crește capacitatea de căldură cu temperatura, care corespunde atât ca număr variabil nonintegral de grade de libertate. Acest comportament al capacității calorice indică eșecul de contact a perfecta reprezentare folosit pentru a descrie proprietățile de gaz reale ale substanței.
Echilibrul și neechilibru Procese .Obratimye și procese ireversibile.
Lăsați cilindrul cu pistonul este umplut cu gaz. Dacă pistonul este fixat, iar temperatura mediului ambiant este neschimbat, gazul din cilindru se află în echilibru termodinamic: presiunea gazului la toate punctele din cadrul aceluiași cilindru, iar temperatura este o temperatură a organelor din jur.
Dacă comprima gazul din cilindru sub piston, atunci starea lui se va schimba: scade volumul și presiunea să crească. Noi vedem că parametrii termodinamici schimba în timp, există, cum se spune, un proces termodinamic. Dar, în cazul în care compresia este foarte lent, apoi la un moment dat va avea timp pentru a stabili o nouă stare de echilibru cu noile valori ale presiunii și a volumului. Astfel de procese lente sunt numite echilibru.
Dacă, după un proces de echilibru lent de compresie pentru a efectua în sens invers, adică. E. Pentru a furniza gaze naturale să se extindă încet, se va trece prin aceeași succesiune de stări de echilibru, și că la compresie. Din acest motiv, procesele de echilibru sunt numite reversibile ..
Schimbarea de stat de proces însoțit de un dezechilibru în sistem, se numește non-echilibru. Lăsați pistonul comprimă gazul din cilindru rapid. Apoi, starea de echilibru va fi rupt, și numai după un anumit timp (timpul de relaxare), gazul trece într-o nouă stare de echilibru. Un astfel de proces de compresie este ireversibil: presiunea de compresie rapidă sub pistonul în primul moment este mai mare decât restul cilindrului, la o expansiune rapidă - mai puțin.
Să presupunem pentru simplitate că ireversibilitatea ciclului datorită faptului că schimbul de căldură între fluidul de lucru și o sursă de căldură (ia în considerare, de asemenea, frigider „sursă“ numai temperatură negativă) are loc la diferențe de temperatură finite, adică incalzitor, renunțând la căldură, răcite la DT. frigider și încălzite la? T.
Orice proces care nu îndeplinește condiția de reversibilitate, am nazyvaemneobratimym proces. Un exemplu de un proces ireversibil este un proces al corpului de frânare sub acțiunea forțelor de frecare. La această viteză a corpului este redusă, și se oprește. Energia mișcării mecanice a corpului este consumată pentru a crește energia mișcării aleatoare a particulelor în organism și mediul înconjurător. Energia este disipată. Pentru a continua procesul de compensare de mișcare necesită răcire a corpului și a mediului. În acest caz, motoare termice, sisteme de încălzire și frigider - nu sunt perfecte, ele nu au o capacitate de căldură infinită, iar în procesul de a primi sau de a da temperatura suplimentară T.?
procese ciclice. Eficiența ciclu. Ciclul Carnot.
Ciclul Carnot - ciclul termodinamic ideale. motor termic Carnot de lucru în conformitate cu acest ciclu are o eficiență maximă a tuturor mașinilor în care ciclul de temperatură maximă și minimă efectuate coincid cu temperaturile minime ale ciclului Carnot și maxime. 2 este format din două procese adiabatic și izoterme.
Otto și Diesel.
Otto ciclu - ciclu termodinamic descrie procesul de lucru al motorului cu ardere internă, cu aprinderea amestecului comprimat de la sursa de alimentare externă, un ciclu motor pe benzină. Numit după inginerul german Nikolaus Otto.
Ciclul ideal Otto este format din patru procese:
Diagrama p-V ciclu Otto
1-2 compresie adiabatică a fluidului de lucru;
2-3 aprovizionare izocoră de căldură fluidului de lucru;
3-4 expansiune adiabatică a fluidului de lucru;
4-1 izocoră răcirea fluidului de lucru.
unde = v2 -n / v1 raportul de compresie,
γ - indicele adiabatic.
Ciclul ideală descrie doar aproximativ procesele într-un adevărat motor, dar pentru calcule tehnice, în cele mai multe cazuri, precizia unei astfel de aproximare este satisfăcătoare.
Ciclul Diesel - ciclu termodinamic descrie procesul de lucru al motorului cu ardere internă cu aprindere a combustibilului injectat din încălzit motorul diesel de lucru ciclu fluid.
Ciclul diesel ideale este format din patru procese:
1-2 compresie adiabatică a fluidului de lucru;
2-3 aprovizionare izobară de căldură fluidului de lucru;
3-4 expansiune adiabatică a fluidului de lucru;
4-1 izocoră răcirea fluidului de lucru.
m = v3 / v2 - factor de expansiune preliminar,
γ - indicele adiabatic.
Ciclul ideală descrie doar aproximativ procesele într-un adevărat motor, dar pentru calcule tehnice, în cele mai multe cazuri, precizia unei astfel de aproximare este satisfăcătoare.