Prezentarea când se dizolvă în apă, ele formează alcaline - de ce aceste metale sunt numite -
Prezentarea pe: „- Atunci când se dizolvă în apă, ele formează alcalin - De ce aceste metale sunt numite“ alcaline „- Și care este alcalin Alkali - săpun la atingere, destul de caustica?“. - Transcrierea:
1

2 - Când se dizolvă în apă, ele formează alcaline - De ce aceste metale sunt numite „alcaline“? - Și ce este alcalin? Alkali - săpun la atingere, mai degrabă substanțe caustice. Ele sunt foarte higroscopice (trage de umiditate). Pe efectele asupra pielii, acestea sunt similare cu acidul - doar erodează și schipyat (dacă este concentrat).
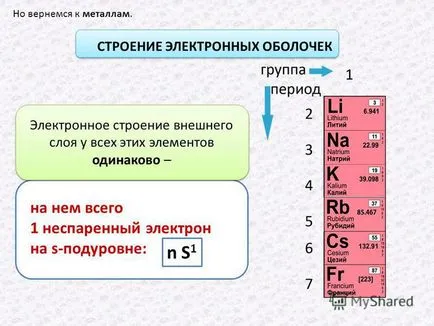
3 Dar înapoi la metale. Electron structura shell pe ea doar un electron nepereche pe s-subnivel: n S 1 Structura electronică a stratului exterior al tuturor acestor elemente sunt la fel -
4 Ca o consecință, de sus în jos, în subgrupul de proprietăți de restaurare amplificate - Ce înseamnă asta? = elemente Valence 1, adică fiecare atom poate forma o legătură 1. Gradul de oxidare a elementelor 1 = - proprietăți metalice - abilitatea de a dona electroni de sus în jos în subgrupei crește raza atomică, prin urmare, cei mai slabi un electron este atras de nucleul atomului - jos proprietăți metalice crește

5

6 PROPRIETĂȚI FIZICE ALE ALCALINE METALE toate conductivitate electrică și termică alb-argintiu culoare (Cs - galbui) ca o densitate de argilă moale de Li, Na și K mai mică de 1 - plutesc pe suprafața apei toate metalele reacționează activ cu apă (higroscopic) - reacționează cu temperaturi ridicate - în esență, arde în aer, scânteie, acestea sunt depozitate sub un strat de parafină

7 Proprietățile fizice ale alcali Metal Toate elementele sunt vopsite într-o diferite flăcări de culoare: Li în roșu Na - K galben - în violet Rb - în roșu-brun Cs - roșu și violet

8 CHIMICE alcaliilor METALE considera proprietățile chimice ale tabelului de compuși anorganici
9 cu oxizi formele oxigen, peroxizi și superoxid de diferite culori: 4Li + O 2 = 2Li 2 O (alb); 2Na + O 2 = Na 2 O 2 (alb); K + O 2 = KO 2 (gălbui); ... Cs 2 O (portocaliu); RBO 2 (maro închis) .... 1. Continuăm săgețile în albastru
10 2Na + Cl 2 2NaCI 4Na + SO 2 2Na 2 O + S 2Na + 2HCI 2 NaCl + H 2 K + NaCI KCl + Na În primele două reacții în mod tradițional, expoziții de sodiu reducătoare proprietăți. Notă ultima reacție - reacția sării de metal nu este orice metal poate intra într-o astfel de reacție!
11 Tabel solubilitate în partea de jos există o linie în această serie fiecare element anterior se poate deplasa ULTERIOR sărurilor sale
12 2. Du-te pe o săgeată verde - reacția oxizilor O + 2Na 2 S + SO 4Na 2 O + 2Na 2 SO 2 Na2SC 3 Na 2 O + 2HCl 2NaCI + H 2 O
13 3. Mergem pe săgeata portocalie
14 6KOH + 3Cl KClO 3 + KCl + 3H 2 O fierbinte 2KOH + Cl 2 KClO + KCl + H 2 O 2KOH rece + SO 2 K 2 SO 3 + H2O KOH + HCI KCl + H 2 O Hot Alkali - oxidare este oxidarea clorului în proporție de 5. Atunci când se utilizează clor alcalin rece oxidat numai la +1 reacție alcalină cu un acid numit reacție de neutralizare. Două substanțe corozive puternice se neutralizează reciproc pentru a forma apa.
Hidrogenul 15 prin reacția cu metale alcaline prezintă o stare de oxidare negativă. Reacțiile metalelor alcaline cu 2Na hidrogen + H2 2NaH Toți compuși ai metalelor alcaline ușor solubil în apă: Astfel, hidruri obținut. singura modalitate de a determina calitatea culorii flăcării și acest oxizi de culoare. Nici precipitarea compușilor nu formează.
16 2LiCl 2Li + Cl2 catod: Li + + e Li anod: 2CI - - 2e Cl 2 4NaOH 4Na + 2H 2 O + O 2 catod: Na + + e Na anod: 4OH - - 4e 2H 2 O + O 2 Prepararea metale metalelor alcaline, de obicei, prin electroliza topiturilor sau săruri alcaline ale acestora: NaCl (electroliză) Na + Cl2
17 de testare 1. Metale alcaline Metale alcaline în proprietăți reacții prezintă: A. B. oxidant reducătorul Q. Cum comburant și un agent de reducere G. vin numai în reacții de schimb 2. Proprietățile de reducere cele mai pronunțate în: A. B. Li Na B. K G. Rb
18 3. Cel mai ușor suferă de oxidare în aer: A. Cs Rb B. B. K Na 4. G. În reacția de metal alcalin cu apă pentru a produce oxizi B. A. oxizi de bază acid de bază B. G. 5. reacția acidului Calitativ sare de potasiu: A. colmatarea B. izolarea precipitatului decolorarea B. G. soluţia de culoare flacără
19 6. Reacție: Na + KCl A. merge să elibereze K B. merge cu separare Cl 2 nu este V. G. merge pentru a forma NaCl 7. KCl + NaNO 3 Reacția A. B. se duce la capăt este deplasată către reactivii în . vine pentru a forma KNO 3 și NaCl nu este H. 8. in electroliza 149 g KCl standuri sare topită: l un gaz de dioxid de l B în gazul G. l 5.6 l de gaz
20 9. In electroliza soluției de sare 149 g KCl alocată: A. 2 g de hidrogen în acid Bytes l l G. 1 g de acid clorhidric 10. Produse de reacție din Na2CO3 + C. A. Na 2 O + CO 2 B. Na + CO 2 B. Na 2 O + CO G. Na + CO
21 ianuarie B 2 D, 3 A, 4, G 5, 6, 7 G 8 A 9 A 10 G