Prepararea acizilor carboxilici
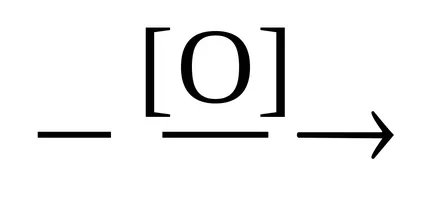
Etapa 1 - formarea de aldehide.
CH3 CH2 OH
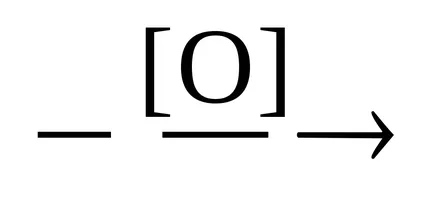
Etapa 2 - produsul dorit.
CH3 CHO
2. Hidroliza nitrililor.
3. oxosynthesis hidrocarburilor nesaturate.
SN3 CH = CH2 + CO + H2O
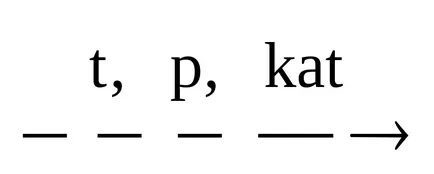
In procesul oxo adesea molecula produse rezultate conțin mai mult de un atom de carbon decât materiile prime.
Proprietățile chimice ale acidului carboxilic
1. Reacții cu grupa carboxil uchastiiem hidrogen.
1.1. Unele acidul disociat substanțial cu eliminarea H + cation.
Așa cum sa menționat mai devreme, pentru acizii carboxilici, caracterizate printr-o constantă de disociere relativ ridicată. Acid formic, avem:

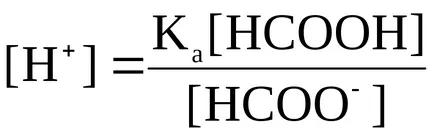
NGS formiat ion; CH3 COO atsetat ion.
1.2. Interacțiunea cu metale
1.3. Interacțiunea cu substanțe alcaline.
RCOOH + NaOH RCOONa + H2O
1.4. Interacțiunea cu oxizi de bază.
1.5. Interacțiunea cu sărurile slabe (similare rezistență) acizi.
2. Reacțiile care implică gruparea carboxil.
2.1. Reacția cu halogenuri de fosfor.
2.2. Reacția cu amoniac. Când amestecarea acidului și amoniacul format inițial sare de amoniu, care este apoi supus la uscat de distilare:
4. oxidare.
Proprietățile reprezentanților individuali ai seriei omoloage
acid formic HCOOH conținut în ac, urzica, în secrețiile furnici. Acesta este - un lichid incolor, cu miros neplăcut picant. Aceasta poate provoca arsuri la nivelul pielii, amestecat cu apă, eteri, alcooli, în orice relație. d = 1,21 g / cm3.
Acetic (etanoic, metilkarbonovaya) Acid CH3 COOH. La temperaturi obișnuite - un lichid incolor, cu miros înțepător. Miscibil cu apa, etanol, dietil și dimetil eter, benzen, în orice relație. Insolubil vCS2. Esenta de otet - soluție 70-80% din CH3 COOH. Otet alimentar - 5% soluție. P.t 17S, p.f. = 118,1S, d = 1,05 g / cm3 este utilizat pentru vopsirea, industria pielăriei, în industria alimentară, pentru prepararea esterilor (acetați).
anhidridă acetică. Tm = 73,1S, bp = 139,5S. Are un miros înțepător, solubil în benzen, eter de dimetil, cloroform. Dipole moment2,82D, H2 O1,84D. Într-o scară largă este utilizat pentru a obține un acetat de celuloză farmaceutice.
Sarcini înrudite
Problema 1. Se calculează fracțiunea de masă a sării într-o soluție a unui acid carboxilic monobazic cu limitarea greutatea inițială de 200 g și o fracție de masă de hidrogen în acidul 8,1% atunci când sarea este formată prin absorbția soluției de amoniac 5.6 L (condiții normale).
Ecuația reacției.
Stabili formula moleculară de acid.
;
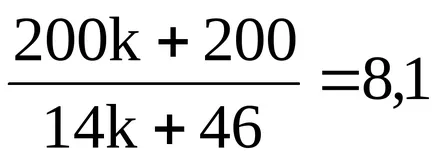
200k + 200 = 113,4k + 372,6;
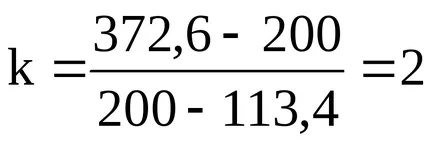
Ecuația reacției rafinat are forma:
din care rezultă:
m2 (soluție) = 200 + 4,25 = 204.25 g
.
Problema 2. Atunci când reacția unui amestec de acizi monocarboxilici de 50 g de oxid de argint cu un exces de 16,8 litri de gaz a fost alocat (condiții normale). Apoi, soluția rezultată a fost trecută printr-un exces de amoniac. Găsiți sarea de masă formată, dacă este prezentă în fracțiunea de masă de oxigen dintr-un amestec echimolecular de acizi este de 60,4%.
Ecuația reacția materiilor prime cu oxid de argint, luând în considerare faptul că limita de acizi monocarboxilici cu ea reacționează numai acid formic.
Folosind ecuația reacției (1) găsim acid formic în greutate:
n (HCOOH) = n (CO2); m (HCOOH) = n (HCOOH) M (HCOOH) =
Gasim formula moleculară necunoscută a acidului carboxilic.
;
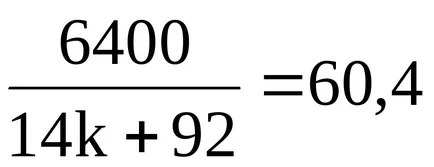
6400 = 845,6k + 5556,8;
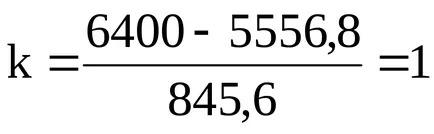
Formula moleculară Acid CH3COOH.
Interacțiunea dintre acid formic cu oxid de argint în soluție de acid poate doar acetic, care prin reacția cu amoniac în exces, pentru a forma o sare conform ecuației reacției:
m (CH3 COOH) = m (amestec) -m (HCOOH) = 50-34.5 = 15,5 g
Din ecuația de reacție (3) avem: