Numărul de nucleoni din nucleul unui atom este egal cu masa atomică relativă element al elementului, rotunjit
Hidrogenul Ar = 1.001; 1 nucleon
Ar Carbon = 12,011; 12 nucleoni.
Nuclizi izotopi, numărul de masă
Majoritatea elementelor în natură, este format din mai multe tipuri de atomi cu diferite valori ale masei atomice relative.
Exemplu. Clorul se găsește în natură ca un amestec de două tipuri de atomi, dintre care unul conține 18 în timp ce celălalt - 20 neutroni in nucleu.
Fiecare tip de atomi (tip nuclee) este nuclid. Nuclizi - este genul de atomi și nuclee, încărcați un anumit număr de protoni și neutroni.
Nuclide aparținând unui element și este unic determinat de numărul de protoni, dar diferiți neutroni în număr, numit nuclides izotopice. sau pur și simplu izotopi.
Izotopi Element - este nuclides cu taxă egală a nucleului (numărul de protoni). Izotopi elementul diferă doar în numărul de neutroni și, prin urmare, numărul total de nucleoni.
Exemplu. Nucleele doi izotopi naturali ai clorului conțin 17 protoni, dar 18 și 20 de neutroni, adică 35 și 37, respectiv nucleoni.
Pentru nuclides exacte valori ale maselor atomice relative sunt întotdeauna aproape de o valoare întreagă, astfel încât masa nuclides poate fi comparat cu aceste valori, numit numărul de masă.
Numărul nuclid masă egal cu numărul de nucleoni conținute de acesta (suma de protoni și neutroni).
simboluri speciale folosite pentru a indica un anumit nuclid. taxa nucleară (numărul ordinal al elementului) - numărul de masă și subscriptul la stânga indexului sus indică simbolul elementului chimic. De exemplu, clor-18 izotop este scris ca.
numărul de masă = numărul de nucleoni din nucleu.
Numărul de ordine = numărul de protoni din nucleu sau numărul de electroni în învelișul unui atom.
Diferența dintre numărul de masă și numărul de ordine = numărul de neutroni din nucleu.
Structura învelișului de electroni al unui atom. nivelurile de energie
Structura învelișului de electroni al atomului definit conținutul energetic diferit E al electronilor individuali din atom. În conformitate cu modelul Bohr al atomului, electronii din atom pot ocupa poziții care corespund cu exactitate determinate (cuantificați) stări energetice.
Numărul de electroni care pot fi la un nivel de energie separat definit prin formula 2n². unde n - numărul de nivel, care este indicat prin cifre arabe 1-7; să se refere de asemenea litere folosite nivelele de energie de la K la Q. maxim de umplere primelor patru nivele de putere, în conformitate cu formula 2n² este: pentru primul nivel K - 2 electroni, al doilea l - 8, al treilea M - 18 și al patrulea nivel N - 32 electron.
Quantum - explicație mecanică a structurii atomilor
Modelul de Orbital atom
idei mecanice cuantice moderne despre structura învelișului de electroni unui atom bazat pe faptul că mișcarea unui electron dintr-un atom nu poate descrie o anumită traiectorie. Este posibil să se ia în considerare numai un anumit volum de spațiu în care electronul. Deoarece electronul are atât de particule și val proprietăți, abordarea explicarea structurii de cochilie de electroni poate fi fie corpuscular teorie și teoria valurilor; ambele conduc la aceeași prezentare intuitiv, formulat ca modelul orbital al atomului.
1. Justificarea modelului orbital al atomului, electronii care provin de natură corpuscular. Acesta este după cum urmează. După cum se poate observa din Fig. 2. Probabilitatea ca electronul in nucleul atomic este zero, este aproape de nucleul este mic, dar în creștere rapidă cu distanța față de miez. La o anumită distanță probabilitatea atinge un maxim și apoi scade încet se apropie asimptotic la zero la infinit distanta. Astfel, este imposibil de a limita spațiul în care electronul poate fi, de exemplu, nu se poate (fără condiții) specifică dimensiunea unui atom. Bazat pe natura corpusculară a electronului se poate vorbi despre o probabilitate de 90% de ședere într-o cantitate limitată de spațiu, care se numește orbital atomic.
Fig. 2. Dependența densității de electroni (sau probabilitatea de a găsi un electron la o distanță r nucleu-electron) într-un atom de distanța de la miezul
2. Justificarea modelului orbital al atomului care vine din natura val al electronului. Acesta este după cum urmează. Electron umple spațiul din jurul nucleului atomic sub forma unui val în picioare, care poate fi reprezentată grafic sub forma unui nor de electroni. Densitatea norului de electroni, norul înțeles ca sarcina electrică a electronilor - densitatea de electroni - ar fi diferit și depinde de distanța electron-nucleu (Fig.1). În timp ce limitează densitatea de electroni la o valoare
90% obținut același model orbital al atomului.
Orbital atomic - o figură geometrică corespunzătoare volumului de spațiu în jurul nucleului, ceea ce corespunde unei probabilități de 90% de a găsi un electron în acest volum (cum ar fi particule) în timp ce o taxă de 90% din densitatea de electroni (ca unde).
Model de orbitali atomice (nor de electroni) este foarte convenabil pentru descrierea vizuală a distribuției densității de electroni în spațiu. Când acest lucru s-orbital are o formă sferică, p orbital - forma dumbbell, d-orbital - floare chetyrehlepestkovogo sau dublu dumbbell, f-orbital - formă mai complexă (figura 3).
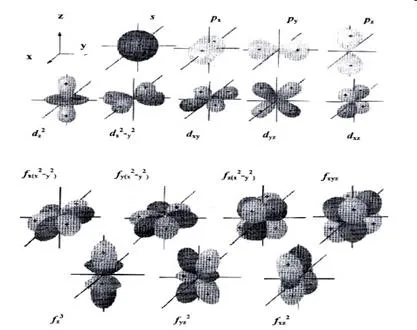
Fig. 3. Formele de S-, p. orbitali d- și f
Dacă atomic orbital este doar un singur electron (ca în atomul de hidrogen), atunci vorbim despre o dată sau pe jumătate ocupată, poluzaselennoy orbitali atomici. Dacă în atomic orbital doi electroni (ca în atomul de heliu), vorbim de un dublu ocupat sau umplut complet, orbitali atomici complet populate. Poluzaselennye SA joacă un rol esențial în formarea legăturilor chimice.
În conformitate cu starea cuantică a electronilor în atom descriere fiecare electron este o particulă individuală. Proprietățile sale, cum ar fi masa și taxa nu relevă diferențe între electronii, în special între electronii care sunt pe aceeași atomic orbital (ca atomul de heliu). caracteristicile intrinseci ale fiecărui electron în atom este de spin.
Doi electroni una orbitali atomici diferă în spate.
Spin - un proprietăți cuantice de electroni, care nu pot fi explicate cu precizie prin conceptele tradiționale, bazate pe comportarea mecanică a particulelor. Excluzând proprietățile undelor de spin de electroni poate fi interpretat prin comparație cu bila de electroni se rotește în jurul unei axe selectată. Spin caracterizează direcția de rotație și, în consecință, pentru cele două direcții posibile de rotație mecanice trebuie să existe două electronice de spin diferit.
Spin - o caracteristică esențială a unui electron dintr-un atom; doi electroni unul atomic orbital au spin opus.
Orbital atomic convenabil reprezentat sub forma unui pătrat, numită celulă cuantică, și fiecare electron - o săgeată verticală care indică una dintre două electron se învârte. celula Quantum cu o singură săgeată indică un orbital atomic al unui electron, adică poluzaselennuyu orbitală, cu două săgeți - atomic orbital cu doi electroni, adică complet populată orbital fără săgeți - .. vacantă orbital, adică fără electroni.
Orbital atomic având o simetrie sferică (vezi fig. 3) pot fi desemnate ca s-orbital (s-AB). iar electronii conținute în ea - ca s-electroni.
Raza crește atomic s-orbitale cu creșterea numărului de nivel de energie; 1s-AB este situat în interiorul 2s-AO, ultima - in SA-3s, etc. centrul nucleului atomic responsabil. În general, structura învelișului de electroni unui atom în modelul orbital apare stratificat. Fiecare nivel de energie conține electroni, geometrically privite ca strat de electroni.
Pentru desemnarea prescurtată a unui electron care ocupă un atomic s-orbital, denumirea în sine s-AO cu indicele de top digital care indică numărul de electroni. De exemplu, 1s - desemnarea de electroni singur atom de hidrogen.
Numărul de nivelul de energie corespunde cu numărul cuantic principal, iar tipul de orbital - numărul cuantic orbital.
2s Li = 1s 2s. Fii = 1s 2s
Formula electronică în combinație cu diagrama energetică a învelișului de electroni al atomului (Fig. 3) reflectă configurația sa de electroni.
Orbital atomic având un (axial) simetrie de rotație, de obicei, notate ca p orbital (p AOS) (Figura 3). există electroni - electroni este p.
Fiecare p-orbital atomic poate primi (la umplere maxim) doi electroni, ca oricare alt AO. Acești electroni ocupă împreună două jumătăți orbitali p. La fiecare nivel de energie atomică (cu excepția primei) are trei orbitali atomici, ceea ce corespunde la maximum șase electroni sedimentare.
Fig. 4. Diagrama statelor electronice de energie ale atomului
Toate cele trei p aos nivel unu energie diferit aranjament spațial; propria axă care trece prin cele două jumătăți și orbital perpendicular pe planul său nodal, formează un sistem de coordonate carteziene (vezi axele proprii x, y, z). De aceea, la fiecare nivel de energie are un set de trei atomice p-orbitali: px -, py - pz și AOS. Literele x, y, z corespunde numărului cuantic magnetic. oferă o indicație a influenței câmpului magnetic extern pe învelișul de electroni al atomului.
orbitali atomici sunt s-toate nivelurile de energie, p orbital atomic - la toate nivelurile, cu excepția primului. La a treia și următoarele niveluri de energie la unul s-AO și trei p aos se alătură cinci orbitali atomice, numite orbitali d (figura 4), în timp ce al patrulea și următoarele niveluri - șapte orbitali atomice, numite f orbitali.
2.3. subnivele energie
atomi mulți electroni. principii
construcția învelișului de electroni
Calcule mecanice cuantice arată că, în multe atomi electroni, un anumit nivel de energie de electroni nu este aceeași; electronii umple orbitali atomici de diferite tipuri și au diferite de energie.
Nivelul de energie este caracterizată prin numărul cuantic principal n. Pentru toate elementele cunoscute ale valorii n variază de la 1 la 7. electronii din atomul de multielectron este situată în starea solului (fără tensiune), a ocupat nivelul de energie de la primul la al șaptelea.
subnivel Energia se caracterizează prin orbitala numărul cuantic l. Pentru fiecare nivel (n = const) numarul cuantic l ia toate valorile întregi de la 0 până la (n-1), de exemplu, când n = 3 valori l sunt 0, 1 și 2. Numărul cuantic orbital determină forma geometrică (simetrie) s orbitali -, p, d-, f -podurovnya. Este evident că, în toate cazurile, n> l; când n = 3, valoarea maximă este de 2 l.
subnivele existente pentru primele patru dintre nivelele de energie ale electronilor orbitali atomice și acestea sunt prezentate în tabelul 1.
Modelul de umplere a cojilor de electroni de atomi este determinat de principiul interzicerii prevăzut în 1925 de fizicianul elvețian Pauli.
Principiul Pauli. într-un atom nu poate fi doi electroni în stări identice.
Electronii diferență de ocupație diferite orbitali atomici un subnivel (n, l = const), cu excepția s-subnivelul, caracterizat prin magnetic număr cuantic m. Acest număr este cunoscut sub numele magnetic caracterizează comportamentul electronilor într-un câmp magnetic extern. Dacă valoarea l determină forma geometrică a orbitali atomice subnivel, valoarea numărului cuantic m stabilește dispunerea spațială reciprocă a acestor orbitali.