Metode pentru prepararea coloizi
coloizi hidrofobi pregătit 2 metode:
I dispersie metodă, sau a unei dispersii (sfărâmare);
Metoda de condensare II (extindere).
dispersare metode realizate de substanțe mecanice, electrice sau cu ultrasunete extrageri granulometriei coloidal. Pentru aceste scopuri, utilizați mori speciale coloid.
Metodele de condensare se bazează pe tranziția și ionul molecular în soluțiile coloidale prin formarea de substanțe cu solubilitate redusă prin reacții chimice sau modificări fizice ale condițiilor de mediu.
Prin condensare metode includ:
1) metode chimice (hidroliză, reacție de dublu schimb, oxidare-reducere);
2) metode de schimb de solvent, în cazul în care mediul de dispersie, în care faza dispersată formează o soluție de compus molecular este înlocuit cu mediu, în care substanța insolubilă.
Prepararea coloizilor prin condensare chimică
4 FeCl3 + 3 K4 [Fe (CN) 6] = Fe4 [Fe (CN) 6] 3 + 12 KCL
2) Hidroliza sare: FeCl3 + 3 H2O = Fe (OH) 3 + 3 HCI
La prepararea coloizi prin condensare chimică a următoarelor condiții:
1) coloizi preparate prin amestecarea soluțiilor foarte diluate de reactanți (de exemplu, AgI), ca la concentrații mai mari de precipitații formate în cantități echivalente;
2) necesare pentru obținerea stabilizatorului sol. Atunci când metodele chimice de preparare a sistemelor coloidale acționează ca un stabilizator al produșilor de reacție.
Structura micelare coloidal considera structura miceliilor în exces ki AgI:
Dacă una dintre materiile prime, luate într-un ușor exces, ea servește ca stabilizator, adică, conferă rezistență la particule AgI coloid. particula coloidal are o structură complicată și este compusă din unitate (un set de un număr mare de molecule). Ionii I - va continua pentru a finaliza construcția unității zăbrele, dându-i o sarcină electrică. Acest ion potențial numitul ion (PRI). Apoi începe contra adsorbit K + (AT). Partea principală a contraionilor adsorbite pe un miez de particulă coloidală, formează împreună cu stratul adsorbit poi, și o porțiune de contraioni (10%) intră în volumul de solvent și formează un strat difuz.
Structura schematică a miceliilor AGI la KI exces este exprimat ca:
. n-am ~. (N - x) K +> x ˉ. x K +
unitate când difuză poi
Strat de particule coloidale forme difuze micelelor: m - numărul de molecule de iodură de argint în miez
n - numărul de ioni de determinare potențiali I ~
(N - x) - numărul asociat contraioni K +. incluse în stratul de adsorbție
x - numărul de ioni de K +. inclus în stratul difuz.
Coagularea lyophobic coloizi
Coagularea - un proces de consolidare a particulelor coloidale prin aderență sub influența unor forțe moleculare de atracție.
Acest proces previne prezența particulelor coloidale de taxe, cum ar fi. Pentru a provoca coagularea Sol, este necesar să se neutraliza sarcina particulelor coloidale, atunci particulele se vor ciocni și se lipesc între ele. Coagularea soluției poate fi accesată în diverse moduri, cel mai ușor prin intermediul electroliți.
Când coagulare coloizi de electroliți este un strat de difuzie de compresie, care permite particulelor coloidale să se apropie unul de altul la o distanță care este deja forțele care operează de atracție intermoleculară.
Distinge de coagulare etapa 2: ascunse și evidente. Când explicit coagulare sol coloratie variază datorită coarsening a particulelor, apare turbiditate și sedimentare ulterioară are loc - fără agregate ale particulelor coloidale de sedimentare prin gravitație.
Pentru apariție evidentă de coagulare a concentrației de electrolit trebuie să fie egală sau mai mare decât pragul de coagulare sol.
Capacitatea coagulante a electroliților caracterizat prag de coagulare (yS), adică concentrația minimă a electrolitului în milimoli pe 1 litru de metoda sol la care începe coagularea limpede. A lua legatura cu valoare de prag de coagulare acțiune numită coagulare (1 / yS).
acțiune coagulante are un singur ion electrolit care are o sarcină opusă sarcina particulelor coloidale.
De exemplu, la solul încărcat pozitiv de anioni de hidroxid de fier exercită o acțiune de coagulare, ci asupra coloidală încărcat negativ Fe4 [Fe (CN) 6] 3 (albastru de Prusia) - cationi.
capacitatea ionilor coagulante este mai mare, cu atât mai mare valență.
stări de +2 electroliți efect coagulante RULE SCHULZE-Gard (în mod tipic de valență) are un semn care este opus sarcina particulelor coloidale, iar acest efect este mai puternic, cu atât mai mare valența ionului coagulante.
Relația dintre pragul de coagulare (yS) și valență (Z) coagulante ion exprimată prin ecuația:
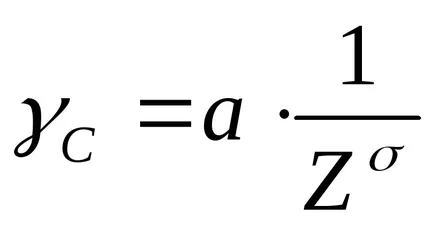
în cazul în care yS - prag de coagulare
și - factorul de proporționalitate.
Conform teoriei Derjaguin, coagulare pragul este invers proporțională cu valența ion coagulante sasea grad:
6. Întrebările pentru auto-cunoaștere:
Înregistrați formula micelii coloizi obținute prin reacții de schimb:
a) cu un exces de CaCl2;
Ce coagulator ionii de electrolit se va coagula Sol: K +. Na +. Ca 2+. Cl ~, Al 3+. [Fe (CN) 6] 3 ~ [Fe (CN) 6] 4 ~? Aranjați ionii selectați din seria liotropic.
Se determină la care electrodul trebuie sa se deplaseze particulele sol obținute prin reacția cu un ușor exces de H2 S: