Legile proprietăților chimice ale elementelor
Legile proprietăților chimice ale elementelor și legăturile acestora pe perioade și grupe
Lista modelele de schimbare a proprietăților expuse în perioade:
- proprietăți metalice sunt reduse;
- proprietăți nemetalice sunt îmbunătățite;
- gradul de oxidare a elementelor în mai mari de oxizi crește de la $ + $ 1 la $ + 7 $ ($ + 8 pentru $ $ Os $ și $ Ru $);
- gradul de oxidare a elementelor în compușii volatili de creșteri de hidrogen de la -4 $ la $ $ -1 $;
- oxizi de bază ale amfoterice înlocuite cu oxizi acizi;
- din hidroxizi alcalini sunt înlocuiți cu acizi amfoterici.
D. I. Mendeleev în $ 1869 $, The încheiat - a formulat legea periodică, care prevede următoarele:
Proprietățile elementelor chimice și compușii lor sunt formate într-o funcție periodică a maselor relative atomice ale elementelor.
Sistematizează elemente chimice pe baza maselor lor relative atomice Mendeleev plătite multă atenție ca proprietățile elementelor și compușilor formați prin ele, distribuirea elementelor cu proprietăți similare, în coloane verticale - grup.
Uneori, ei au identificat un model de încălcare, Mendeleev pune elemente mai grele, cu valori mai mici de masa atomică relativă. De exemplu, este înregistrat într-un tabel în fața nichel cobalt, telur, iod înainte, și atunci când este deschis inert gaz (nobil) - argon înainte de potasiu. Acest ordin de aranjament de Mendeleev considerat necesar deoarece altfel aceste elemente ar cădea în grupul de elemente diferite pentru a le în proprietăți, în special potasiu metal alcalin ar lovi grupul de gaze inerte, iar gazul inert este argon - în grupul de metale alcaline.
D. I. Mendeleev nu a putut explica aceste excepții de la regula generală, și nu a putut explica cauza cauza proprietăților periodicității elementelor și compușilor formate de acestea. Cu toate acestea, el a prezis că motivul pentru care se află în structura complexă a atomului, structura internă a ceea ce nu era cunoscut la momentul respectiv.
În conformitate cu conceptele moderne ale structurii atomice, baza pentru clasificarea elementelor chimice sunt taxele de nucleele lor, precum și formularea actuală a legii periodice este după cum urmează:
Proprietățile elementelor chimice și a substanțelor formate de acestea sunt responsabile periodic, în funcție de nucleele atomice.
modificări de frecvență ale proprietăților elementelor repetarea periodică este explicată în structura nivelelor energetice externe ale atomilor. Acesta este numărul de niveluri de energie, numărul total de electroni situate pe ele, iar numărul de electroni reflectă extern simbolurile recepționate din tabelul periodic, adică, dezvăluie semnificația fizică a numărului perioadei, numărul de grup și numărul de ordine al elementului.
Structura atomului și poate explica motivele pentru schimbarea proprietăților metalice și nemetalice ale elementelor în grupe și perioade.
Legea periodică și tabelul periodic al elementelor D. I. Mendeleeva rezumă informații despre elementele chimice și substanțele formate de acestea și să explice periodicitatea în schimbarea proprietăților lor și motivul pentru similitudinea proprietăților elementelor din același grup. Cele două cele mai importante valori ale legii periodice și a sistemului periodic completează unul pe altul, care este abilitatea de a prezice, și anume prezice și descrie proprietățile pentru a specifica modul în care descoperirea de noi elemente chimice.
Caracteristicile generale ale metalelor din principalele subgrupe I ± grupe III în raport cu poziția lor în sistemul periodic al elementelor chimice D. I. Mendeleeva și caracteristicile structurale ale atomilor lor
Elemente chimice - metale
Majoritatea elementelor chimice se referă la metale - $ 92 $ $ 114 $ din elementele cunoscute.
Toate metalele cu excepția mercurului în stare normală - substanțele solide și au un număr de proprietăți comune.
Metale - un maleabil, ductil, maleabil substanță cu luciu metalic și poate efectua căldură și electricitate.
Atomii elementelor metalice exterioare dona electroni (și unele predvneshnego) strat electronic, devenind ioni pozitivi.
Această proprietate de atomi de metal, după cum știți, determinată de faptul că acestea au o rază relativ mare și un număr mic de electroni (în general, de la $ 1 la $ $ $ 3 de pe stratul exterior).
Singurele excepții sunt $ 6 $ atomi metale germaniu, staniu, plumb, pe stratul exterior au un $ electron $ 4, atomi de antimoniu și bismut - $ 5 $, poloniu atomi - $ 6 $.
Pentru atomii de metal caracterizate prin valori mici ale electronegativitate (de la 0.7 $ la $ 1.9 $ $) și proprietăți extrem de reducătoare, adică capacitatea de a dona electroni.
Știți deja că, în tabelul periodic al elementelor chimice a metalelor D. I. Mendeleeva sunt sub diagonala Bor - astatin, și deasupra ei, în sub-grupuri. Perioadele și principalele subgrupe sunt cunoscute schimbați tipare în metal și deci reducerea proprietăților atomilor elementului.
Elemente chimice situate în apropierea borului diagonal - astatin ($ Be, Al, Ti, Ge, Nb, Sb $), au proprietăți duale: unii dintre compușii lor se comportă ca și metale, alte nemetale prezintă proprietăți.
Subgrupurile de proprietăți de regenerare a metalelor, cu creșterea numărului atomic adesea redus.
Acest lucru poate fi explicat prin faptul că electronii din forța de legătură de valență cu nucleul atomilor acestor metale afectează în mare măsură amploarea taxei nucleare, nu raza atomica. Amploarea taxei nucleare crește în mod semnificativ, atragerea de electroni pentru a crește nucleu. Raza atomului în același timp, deși în creștere, dar nu la fel de mult ca și în principalele metale de grup.
Substanțe simple formate din elemente chimice - metale și substanțe complexe care conțin metale joacă un rol important în minerale și organice „viață“ a Pământului. Este suficient să amintim că atomii (ioni) de elemente metalice sunt o componentă de compuși care determină metabolismul la om și animale. De exemplu, ea a găsit $ 76 $ celule din sânge uman, din care doar $ 14 $ nu sunt metale. La om, unele metale elements- (calciu, potasiu, sodiu, magneziu) prezenți în cantitate mare, adică, Ele sunt macrocelule. Un metal cum ar fi crom, mangan, fier, cobalt, cupru, zinc și molibden sunt prezente în cantități mici, adică, această urmă.
Metale avilable subgrupe principale grupe I-III.
Metale - un grup de metal principal din grupa I. atomilor lor în nivelul energetic exterior sunt un electron. Metale - puternic agenți de reducere. reductibilitatea și reactivitatea lor crește odată cu creșterea numărului atomic al elementului (adică în jos în tabelul periodic). Toate acestea au o conductivitate electronică. Rezistența legăturii dintre atomii de metale alcaline se reduce odată cu creșterea numărului atomic al elementului. De asemenea, în scădere punctele lor de topire și de fierbere. metalele alcaline reacționează cu multe substanțe simple - oxidanți. În reacțiile cu apă formează o bază solubilă în apă (alcaline).
Elementele alcalino-pământoase sunt numite elemente ale subgrupului principal al grupului II. Atomii acestor elemente conținute de nivelul de energie exterioară a doi electroni. Acestea sunt agenți de reducere, au un grad de oxidare de $ 2 + $. In acest Caracteristicele generale subgrupă observate modificări ale proprietăților fizice și chimice asociate cu creșterea dimensiunii atomilor din grupa de sus în jos, și de asemenea slăbi legătura chimică dintre atomii. Cu o dimensiune mai mare de ioni de proprietăți acide și bazice sunt mai slabe oxizi și hidroxizi îmbunătățite.
Subgrupa III elemente principale de grup cuprind bor, aluminiu, galiu, indiu și taliu. Toate elementele sunt $ p $ -elements. La nivelul energetic exterior, au trei $ (s ^ 2p ^ 1) $ electronului, ceea ce explică similitudinea proprietăților. Gradul de oxidare + $ 3 $. În grupul de metal cu creșterea proprietăților de încărcare a crește nucleului. Bor - elementul metaloid, in timp ce aluminiul are proprietati metalice. Toate elementele care formează oxizi și hidroxizi.
Caracterizarea elementelor de tranziție ± cupru, zinc, crom, fier în funcție de poziția lor în Sistemul Periodic al Elementelor D. I. Mendeleeva și caracteristicile structurale ale atomilor
Majoritatea elementelor metalice este într-o grupă laterală a sistemului periodic.
În a patra perioadă din atomii de potasiu și calciu, există un al patrulea strat electronic umplut $ 4s $ -poduroven, deoarece are o energie mai mic decât $ 3d $ -poduroven. $ K, Ca - s $ sunt elemente care aparțin grupului principal. atomii Y la $ Sc $ $ Zn $ umplut cu electroni $ 3d $ -poduroven.
Luați în considerare ce forțe acționează asupra electronului, care se adaugă la un atom cu creșteri de încărcare nucleare. Pe de o parte, atracția nucleului atomic, cauzand electronii ocupă cel mai scăzut nivel de energie liberă. Pe de altă parte, repulsia electroni existente. Când nivelul de energie este de $ 8 $ electroni (ocupat și $ $ $ $ S p orbitali), efectul lor totală repelent atât de mult încât următorul electronul intră în loc de energie sub $ d- $ orbital la o mai mare $ $ S orbitală nivelul următor. Structura electronică a nivelurilor de energie externe în $ potasiu. 3d ^ 4s ^ 1 $ pentru calciu - $. 3d ^ 4s ^ 2 $.
Urmat de adăugarea de încă un electron în Scandiu duce sus $ umplere $ 3d orbitală în loc de energie $ 4p $ orbitali încă mai mare. Este energetic favorabil. Completarea $ 3d $ orbitalii termină în zinc, care are o structură electronică de $ 1s ^ 2s ^ 2p ^ 3s ^ 3p ^ 3d ^ 4s ^ 2 $. Trebuie remarcat faptul că elementele de cupru și crom observat fenomenul de „eșec“ de electroni. În atom de cupru zecea $ d $ -electron se mută la a treia $ 3d $ -poduroven.
formula E de cupru $. 3d ^ 4s ^ 1 $. In atomii de crom în al patrulea nivel de energie ($ s $ orbitală) trebuie să fie $ 2 $ ale electronului. Cu toate acestea, unul dintre cei doi electroni sunt transferate la un nivel de energie al treilea la neumplut orbitală $ d $, formula sa de electroni. 3d ^ 4s ^ 1 $.
Astfel, spre deosebire de elementele principale de grup, în care o umplere treptată a orbitali de electroni nivel atomic exterior la elementele laterale ale subgrupelor umplute $ d $ penultimul nivel de energie orbital. De aici și numele: $ d $ -elements.
Toate substanțele simple de elemente ale subgrupe ale sistemului periodic formate sunt metale. Datorită numărului mai mare de orbitali atomici decât elementele metalice ale principalelor subgrupurilor atomi $ d $ -elements formează un număr mare de legături chimice între ele și, prin urmare, a crea un grilaj mai solid. Este mai puternic și mecanic, precum și în ceea ce privește căldură. Metalele subgrupe secundare - cel mai durabil și refractar la toate metalele.
Este cunoscut, dacă atomul are mai mult de trei electroni de valență, elementul prezintă o valență variabilă. Acest lucru este valabil pentru cele mai multe dintre $ d $ -elements. valența lor maximă, la fel ca elementele grupului principal, este numărul de grup (deși există excepții). Elementele cu același număr de electroni de valență sunt în grupul cu același număr $ (Fe, Co, Ni) $.
La $ d $ -elements modifica proprietățile de oxizi și hidroxizi lor, în aceeași perioadă, se deplasează de la stânga la dreapta, adică, pentru a crește valența lor derivă din proprietățile fundamentale ale amfoter acide prin. De exemplu, crom are o valență $ + 2, +3, + $ 6; și oxizii săi: $ $ CrO - bază, $ Cr_O_3 $ - amfoteri, $ CrO_3 $ - Acid.
Caracteristici generale ale grupului IV principale nemetalic ± VII grupuri în ceea ce privește poziția lor în sistemul periodic al elementelor chimice D. I. Mendeleeva și caracteristicile structurale ale atomilor lor
Elemente chimice - nemetale
Chiar prima clasificare științifică a elementelor chimice au fost divizare în metale și nemetale. Această clasificare nu și-a pierdut semnificația în prezent.
Metaloizi - sunt elemente chimice pentru atomi care este capacitatea caracteristică de a accepta electroni de finalizare datorită prezenței stratului exterior, de obicei, pe stratul de electroni extern patru sau mai mulți electroni și atomii de rază mică în comparație cu atomii de metal.
Această definiție lasă deoparte elementele principale ale grupa VIII subgrupe - gaze inerte sau nobile ale căror atomi au terminat strat exterior de electroni. Configurația electronică a atomilor acestor elemente este că ele nu pot fi atribuite metale sau nemetale la. Ele sunt acele obiecte care au în comun elemente de metale și nemetale, luând o poziție de delimitare între acestea. Gazele inerte sau nobile ( „nobil“ exprimat în inerție), denumite uneori nemetale, dar nu în mod formal, din motive fizice. Aceste substanțe păstrează în stare gazoasă până la temperaturi foarte scăzute. Astfel, nu heliu lichefiază la $ t ° = -268,9 ° C $.
Inerția pe cale chimică a acestor elemente este relativă. Pentru xenon si krypton sunt compuși cu fluor și oxigen :. $ KrF_2, XeF_2, XeF_4 $ etc cunoscute Fără îndoială, formarea acestor compuși, gaze inerte a acționat ca reductori.
Din definiția blanei care pentru atomii lor au mare valoare electronegativitate. Aceasta variază de la $ 2 la $ 4 $ $. Nemetale - un grup principal elemente, mai ales $ r $ -elements, cu excepția hidrogenului - s element.
Toate elementele nemetalice (altele decât hidrogen) ocupă Sistemul periodic al elementelor D. I. Mendeleeva colțul din dreapta sus, un triunghi al cărui apex este fluor $ $ F, și baza - diagonală $ B - la $.
Cu toate acestea, accentul trebuie pus pe hidrogen poziția dublă în tabelul periodic: În marile subgrupele I și VII grupe. Acesta nu este un accident. Pe de o parte, un atom de hidrogen, un atom de metal alcalin cum ar fi, are pe exterior (și numai el) electron-un singur strat de electroni (configuratia electronilor $ 1s ^ $ 1), care este în măsură să dea, prezentând proprietățile unui agent de reducere.
In majoritatea compușilor lor de hidrogen, cum ar fi metalele alcaline și prezintă un grad de oxidare de $ 1 + $. Dar, un atom de hidrogen readucere electroni are loc mai greu decât atomii de metal alcalin. Pe de altă parte, atomul de hidrogen ca atomi de halogen, până la terminarea unui strat electronic extern îi lipsește un electron, astfel încât atomul de hidrogen poate accepta un electron, care prezintă proprietăți ale oxidant și oxidare caracteristic halogen stare - $ 1 $ hidruri (compuși ai metalelor, astfel de compuși halogen metal - halogenuri). Dar atașarea unui electron la un atom de hidrogen are loc mai greu decât halogeni.
Proprietăți elemente atomi - nemetale
La atomii metaloid predomină proprietățile oxidante, adică, capacitatea de a atașa electroni. Această capacitate caracterizează valoare electronegativitate care variază în mod regulat în perioadele și subgrupuri.
Fluor - cel mai puternic oxidant al atomilor săi în reacții chimice care nu este capabil de electroni donând, adică prezintă proprietăți de reducere.
Configurația straturilor exterioare de electroni.
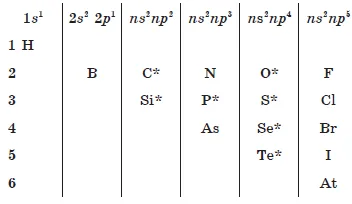
În perioada:
- crește taxa nucleară;
- scade raza atomica;
- numărul de electroni în crește strat exterior;
- crește electronegativitate;
- proprietăți oxidante sunt îmbunătățite;
- proprietăți nemetalice sunt îmbunătățite.
Principalele sub-grupe:
- crește taxa nucleară;
- crește raza atomică;
- numărul de electroni din stratul exterior nu este modificat;
- scade electronegativitate;
- proprietățile oxidante sunt slăbite;
- proprietăți nemetalice slăbi.
Alte nemetale pot prezenta proprietăți de reducere, deși într-o măsură mult mai mică în comparație cu metalele; în perioadele și subgrupe reziliență variază în ordine inversă comparativ cu oxidantul.
Elemente chimice, metaloid $ 16 $! Destul de un pic, dacă luăm în considerare că știm $ 114 $ elemente. Două elemente metaloid se completează până $ 76% $ masa scoarța terestră. Acest oxigen (49 $% $) și siliciu ($ 27% $). Atmosfera conține $ $ 0.03% în masă de oxigen în crusta. Metaloizi sunt $ 98,5% $ greutate de plante, $ 97,6% în greutate $ a corpului uman. Nemetale $ C, H, O, N, S, P $ - organogenă care formează substanțele organice majore de celule vii: proteine, grăsimi, carbohidrați, acizi nucleici. În compoziția aerului pe care îl respirăm includ substanțe simple și complexe, ca elemente formate, nemetale (O_2 $ $ oxigen, azot $ N_2 $, dioxid de carbon SO_2 $ $, vapori de apă N_2O $ $ et al.).