Legea periodică, sistemul și setat pe (stryhome) buletinul informativ
1. Istoria descoperirii legii periodice și tabelul elementelor chimice ale Mendeleev.
2. Legea periodic în formularea Mendeleev.
3. Formularea moderna a legii periodice.
4. Valoarea legii periodic al elementelor chimice și Mendeleev.
5. Tabelul periodic al elementelor - reflectarea grafică a legii periodice. Structura sistemului periodic: perioade, grupe, subgrupe.
6. Dependența proprietăților elementelor chimice din structura atomilor lor.
Mendeleev
(1834-1907)
O astfel de formulare și confirmă prezența izotopilor, proprietăți chimice, care sunt identice, deși masa atomică diferită.
legea periodică - una dintre legile de bază ale naturii și cele mai importante legi ale chimiei. Odată cu deschiderea acestei legi începe stadiul actual de dezvoltare a științei chimice. Deși sensul fizic al legii periodice a devenit clar numai după crearea teoriei structurii atomice, teoria în sine a evoluat pe baza legii periodice și tabelul elementelor chimice. Legea ajută oamenii de știință pentru a crea noi elemente chimice și elemente noi conexiuni, de a primi un material cu proprietățile dorite. Mendeleev însuși a prezis existența 12 elemente, care la acel moment nu au fost descoperite, și a determinat poziția lor în sistemul periodic. Proprietățile acestor trei elemente el a descris în detaliu, și viața omului de știință, aceste elemente au fost deschise ( „ekabor“ - galiu, „EKA-aluminiu“ - scandiu, „ekasilitsy“ - Germania). În plus, legea periodică este de mare importanță filosofică, confirmând legile cele mai generale ale naturii.
reflectare grafică a legii periodice este un sistem periodic al elementelor chimice. Există mai multe forme ale sistemului periodic (scurt, lung, scara (propusă de Niels Bohr), spirală). În România, forma cea mai răspândită scurt. Sistemul periodic modern, conține 110 data deschisă a elementelor chimice, fiecare dintre acestea ocupă un anumit loc, are numărul său de serie și numele. Tabelul rânduri orizontale izolate - perioade (1-3 - mici, sunt compuse dintr-un singur rând; 4-6 - mari, compuse din două rânduri, perioada a 7 - neterminat). În plus față de perioadele de rânduri verticale izolate - grupuri, fiecare dintre care este divizat în două subgrupuri (principale - și laterale și - b). subgrupe laterale conțin elemente numai pe perioade mari, ele prezintă proprietăți metalice. Elemente ale unui subgrup au aceeași structură a cojilor de electroni exterioare, ceea ce le face proprietăți chimice similare.
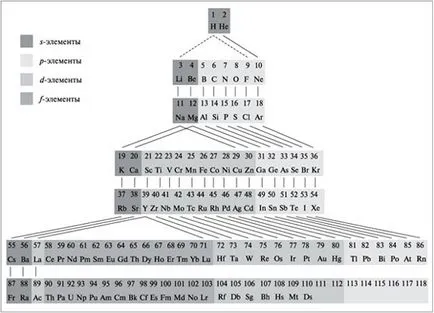
Ladder formă Mendeleev sistem periodic al elementelor
Perioada de - o secvență de elemente (de la un metal alcalin la gaz inert), a cărui atomi au același număr de nivele de energie egal cu numărul perioadei.
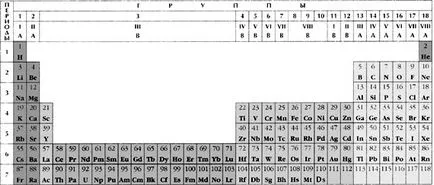
Forma lungă a sistemului periodic al elementelor Mendeleev
Prima subgrupă - o serie de elemente verticale ale căror atomi au același număr de electroni în nivelul energetic exterior. Acest număr este egal cu numărul grupului (cu excepția hidrogenului și heliu).
Toate elementele din sistemul periodic sunt împărțite în patru familii de electroni (s -, p -, d -,
f-elemente), în funcție de care sub-strat în celulă este umplută cu ultimul atom.
Incidental subgrupă - un rând vertical-elemente d având același număr total de electroni de pe stratul -podurovne d predvneshnego -podurovne s și stratul exterior. Acest număr este de obicei egal cu numărul de grup.
Cele mai importante proprietăți sunt elementele chimice și nemetallichnost metalicitate.
Metalicitate - capacitatea unui electron element chimic donor de atomi. Cantitativă metalicitate caracteristică este energia de ionizare.
Energia de ionizare a atomului - cantitatea de energie necesară pentru a elimina un electron dintr-un element de atom, adică pentru a transforma atomul într-un cation ... Energia de ionizare inferioară, atomul mai ușor donează un electron, proprietatile metalice puternice ale unui element.
Nemetallichnost - abilitatea de a atașa element chimic, electroni atomi. caracteristică cantitativă Nemetallichnosti este afinitatea de electroni.
Electron de afinitate - este energia care este eliberată atunci când aderarea la electron la un atom neutru, adică, conversia unui atom în anionul ... Cu cât mai mare afinitate de electroni, cu atât mai ușor electronul atașează atom, cu atât proprietățile nemetalice ale unui element.
Universal metalicitate caracteristic și electronegativitate nemetallichnosti este elementul (EO).
Element EO descrie capacitatea atomilor săi de a atrage electroni care participă la formarea de legături chimice cu alți atomi în moleculă.
Cu cât este mai metalicitate, OE inferior.
Cu cât este mai nemetallichnost, mai mult EO.
La stabilirea valorilor relative la OE scara Pauling per unitate adoptat EO atom de litiu (EO (Li) = 1); elementul cel mai electronegativ este fluor (EE (F) = 4).
În perioadele de metal alcalin scăzut la gaz inert:
• însărcinarea atomice crește nuclee;
• numărul de niveluri de energie nu este schimbat;
• numărul de electroni la exterior crește nivelul de la 1 la 8;
• Raza scade atomi;
• Puterea de conectare a stratului exterior crește electroni cu nucleu;
• creșterea energiei; Ionizare
• crește afinitate de electroni;
• Elemente de metalicitate scade;
• Elemente de nemetallichnost crește.
Toate-elemente d perioade date similare în proprietățile lor - toate acestea sunt metale, ele sunt mici raze atomice diferite si valoarea EO, deoarece acestea conțin același număr de electroni în nivelul exterior (de exemplu, în perioada a 4 - cu excepția Cr și Cu).
Principalele sub-grupuri de sus în jos:
• Numărul de niveluri de energie dintr-un atom crește;
• numărul de electroni la nivelul exterior egal;
• crește raza atomică;
• stratul exterior al puterii electronilor legăturii scade cu miez;
• scăderi de energie; Ionizare
• scăderi de afinitate de electroni;
• Elemente de metalicitate crește;
• Elemente de nemetallichnost scade.
test de corelate
„Legea periodică și sistemul a elementelor chimice ale Mendeleev"
(mai multe răspunsuri corecte)
1. Dintre toate elementele din grupa principala I element de grup litiu are:
a) proprietățile metalice mai pronunțate;
b) cea mai mică densitate;
c) cea mai mare masă atomică relativă;
g) cea mai mică rază a atomului.
oxid 2. Formula Ipotetice mai mare a elementului 115 al sistemului periodic poate fi de forma:
3. Numărul de ordine al elementului cu cea mai mare electronegativitatea din grupul sistem periodic 4:
a) 6; b) 72; c) 82; g) 12.
4. Nivelurile de energie Cât de mult umplute cu electroni în ioni de potasiu?
a) 4; b) 3; c) 6; d) 5.
5. În timpul arderii materiei organice a 1,86 g de 3,96 g de dioxid de carbon format și 0,54g de apă. Cât de mulți atomi cuprinzând molecula acestui compus, dacă este cunoscut faptul că masa sa molară este mai mică de 200 g / mol?
a) 3; b) 2; c) 15; g) 13.
6. Care sunt rândurile elementelor chimice care nu sunt enumerate în ordinea descrescătoare a razelor atomice?
a) Ca, Mg, Be; b) S, CI, Br;
in) Li, Na, K; g) B, Be, Li.
7. Energia de ionizare a ordine crescătoare sunt următoarele elemente:
a) Na, Mg, Al, Si; b) Na, Mg, Ca, Si;
a) Na, Ca, Mg, Si; g) Si, Al, Mg, Na.
8. De origine (etimologia) „ciudat“ numele din lista de elemente pentru a fi:
a) seleniu; b) telur; c) niobiu; g) ceriu.
9. identic în valoare absolută, dar este diferit în semn cu valoarea gradului de oxidare a hidrogenului în compus volatil și oxidul are un element superior:
a) bor; b) azot; c) sulf; g) carbon.
10. Proprietățile superioare ale oxizilor elementelor treia perioadă se modifică după cum urmează:
a) amfoterice, bazic, acid;
b) o bază, acid, amfoter;
c) de bază, amfoter sau acid;
g) acid, amfoter sau bazic.
1. Se calculează compoziția izotopică (%) de hidrogen (media masa atomica relativa Ar = 1,008) și litiu (Ar = 6,9), presupunând că fiecare element este format numai din doi izotopi ai greutăți atomice relative ale care diferă de unul.
Răspuns. Hidrogenul: 1 H - și 99,2% H2 - 0,8%;
Litiu: 6 Li - 10% și 7 Li - 90%.
2. Masa atomica relativa a hidrogenului este natural 1.00797. Acesta este un amestec de hidrogen izotopilor protiu (Ar = 1,00782) și deuteriu (Ar = 2,0141). Ce procent de deuteriu în hidrogen natural?
3. Printre elementele de mai sus de caractere indică izotopi și isobars:
Răspuns. În același izotopi, simbolurile chimice,
isobars în aceeași greutate atomică.
4. litiu natural (Ar = 6,9) este format din izotopi cu numere de masă 6 și 7. Ce procent din primul izotop * conține?
5. Greutatea izotop atom de magneziu este 4,15 • 10 -23 Se determină numărul de neutroni, care cuprinde nucleul atomului.
6. Cuprul are doi izotopi cu numere de masă 63 și 65. Fracțiunea de masă a cuprului în natural este, respectiv, 73% și 27%. Pe baza acestor date, se calculează masa medie relativă atomică a cuprului natural.
Să m (proba) = 100 g, apoi m (63 Cu) = 73 g; m (65 Cu) = '27

7. Greutatea medie atomica a clorului este natural 35,45. Se calculează fracțiile masice ale celor doi izotopi cu un număr de masă de 35 și 37.
Răspuns. 77,5% și 22,5%.
8. Se determină masa atomica relativa de bor, dacă cunoaștem fracțiile masice ale izotopilor
(10) = 19,6% și (11) = 80,4%.
9. Li este format din doi izotopi naturali cu numere de masă 6 (1 = 7,52%) și
7 (2 = 92.48%). Calculați masa atomică relativă a litiului.
10. Calculați masa atomică relativă de cobalt, dacă se știe că în natură există doi izotopi săi cu numere de masă 57 (1 = 0,17%) și 59 (2 = 99,83%).
Răspuns. 18,9% și 81,1%.
12. Gallium are doi izotopi naturali cu numere de masă 69 și 71. Într-un raport cantitativ sunt între un număr de atomi ai acestor izotopi, dacă greutatea atomică relativă 69,72 element.
13. bromul natural are doi izotopi cu numere de masă 79 și 81. Masa atomica relativa a 79.904 de brom. Se determină fracțiunea de masă a fiecăruia dintre izotopi în brom natural.
Răspuns. 54,8% și 45,2%.
Răspuns. 94,55%;
18 tipuri de molecule de dioxid de siliciu.
2. Eșantionul este format dintr-un amestec de doi izotopi ai aceluiași element; 30% din izotopul în nucleul unui atom care - 18 neutroni; 70% din izotopul în nucleul unui atom care - 20 neutroni. Se determină numărul de ordine al elementului, dacă masa atomică relativă medie a elementului într-un amestec de izotopi este 36,4.
3. Elementul chimic este format din doi izotopi. La baza primului atom de izotopi - 10 protoni si 10 neutroni. La baza al doilea atom de izotopi - neutronii pentru 2 mai. La 9 atomi mai ușoare de izotopi un atom al unui izotop mai greu. Se calculează elementul relativ mediu de masă atomică.
4. 137 Cs izotop are un timp de înjumătățire de 29,7 ani. 1 g din acest izotop reacționează exploziv cu apă în exces. Care este perioada de înjumătățire a cesiu în compusul rezultat? Justificați răspunsul.
5. După cât de mulți ani cantitatea de stronțiu-90 radioactiv (timp de înjumătățire de 27 de ani), care a scăzut la emanatii radioactive de la o explozie nucleară, va fi mai mică de 1,5% din suma cu care a fost găsit la momentul respectiv, după o explozie nucleară?
Răspuns. 163.35 ani.
6. Metoda trasoare izotopi radioactivi sunt utilizați în scopul de a „traceroute“ a unui element în organism. Astfel, un pacient cu un preparat pancreas bolnav se administrează iod radioactiv-131 (izotop - suferă o descompunere), care permite medicului sa monitorizeze trecerea de iod prin corpul pacientului. Scrieți ecuația dezintegrare radioactivă și se calculează, după care timp cantitatea de iod radioactiv, introdus în organism pentru a reduce cu 10 ori (semiperioada 8 zile).
7. Cât timp este nevoie pentru a deveni trei sferturi din nichel din cupru, ca urmare a - degradare, în cazul în care perioada de înjumătățire a izotopului 63 Ni este de 28 până la 120 de ani?
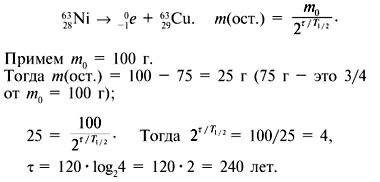
8. Localizati 81 greutate izotopilor Sr (timp de înjumătățire de 8,5 ore), restul după 25,5 ore de depozitare, în cazul în care greutatea inițială a fost de 200 mg.
9. Se calculează procentul de atomi de izotopul 128 I (timp de înjumătățire de 25 de minute), restul nondecomposed după depozitare timp de 2,5 ore.
10. Timpul de înjumătățire -. Izotop 24 Na-radioactiv este de 14,8 ore Scrieți reacția de dezintegrare și de a calcula cât de multe grame de produs fiica este format din 24 g din acest izotop timp de 29,6 ore.
11. Izotopul 210 Po -particle electroluminiscente utilizate în amestec cu surse de beriliu neutroni. După ceva timp, intensitatea acestor surse va scădea cu 32 de ori? Timpul de înjumătățire a izotopului este de 138 de zile.
Exerciții reacții nucleare
1. Cât de mult - și - particule a pierdut nucleul de 226 Ra pentru elementul copil cu numărul de masă 206, aparținând grupei IV din tabelul periodic? Numele acestui element.
2. Nucleul 92 al izotopul U 238 atomi în dezintegrarea radioactivă a nucleului devin 226 88 Ra. Cum - și - particule a dat afara in timp ce nucleul inițial?
Răspuns. 3, 2 -.
3. izotopice 9 Be, absorbind și care emit un -particle de neutroni, transformat într-un izotop al unui alt element. Care element este format? Scrieți ecuația unei reacții nucleare.
Răspuns. Un izotop 12 C în ecuația unei reacții nucleare:
4. Atomii de 238 U-particule emit. S-a obținut în acest element de alți atomi emit
- -particles, atomii formați element nou care emit - -particles. Se determină izotop al unui element format ca urmare a transformărilor succesive.
5. Primul din istoria reacției nucleare artificiale a fost o reacție la izotopilor 14 N-particule derivate din dezintegrarea 210 Po. Ca urmare a reacției nucleare transformat în izotopului de oxigen azot 17 O ecuație Write care apar transmutații nucleare.
* Termenul „izotopului“ În prezent, în literatura de specialitate pentru a desemna felul de atomi cu un număr specific în nucleul său de protoni și neutroni este utilizat. Nuclide un singur element - l izotopi. Utilizați termenul „izotopul“ în IUPAP singular și IUPAC nu sunt recomandate. -Prim. Ed.
Și totuși lucrarea a legii periodice și legile de bază