hipoclorit de sodiu
Formula structurală a hipocloritului de sodiu cu marcate pe atomii ei de sarcină
hipoclorit de sodiu. sare de sodiu a acidului hipocloros este o substanță chimică care are formula chimică NaOCl, utilizat ca înălbitor și dezinfectant, soluții apoase ale substanțelor utilizate în stomatologie ca irigant.
proprietățile fizice
- Există trei hidrat cunoscute cristalin al compusului: monohidrat, NaOCl * 2,5 H2 și topotecan NaOCl * 5 H2O
- Forma liberă este o substanță cristalină albă, foarte instabil.
- Mai stabil în formă de NaOCl * 2,5 H2O, este relativ stabil sub formă de pentahidrat NaOCl * 5 H2O sau soluții apoase.
- oxidant puternic având proprietăți corozive.
- Densitate - 1,11 g / cm3; 1,574 g / cm3 (topotecan); 1,04 g / cm3 (densitatea soluției populare dentare 5-6% apos, la temperatura camerei).
- Punct de topire: la liber sodiu are loc tranziția de fază hipocloritul; NaOCl * 2,5 H2O - 57,5 C; NaOCl * 5 H2O - 24,4 C.
- Punctul de congelare al soluțiilor apoase: 0,8% - -1 C; 2% - -2.2 C; 4% - -4.4 C; 6% - -7.5 C.
- Solubilitatea în apă - 53,4 g / 100 ml (la temperatura de 20 ° C), 130 g / 100 ml (la temperatura de 50 ° C).
chimice
Hipocloritul de sodiu este un compus instabil și ușor descompus prin următoarele reacții:
Când încălzirea are loc în reacție paralel și disproporționare:
3 NaOCl = NaClO3 + 2 NaCl
Hidroliza și dezintegrarea în soluții apoase
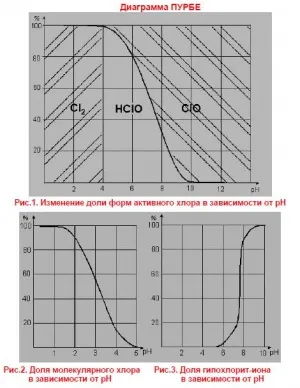
Schimbarea sub formă de soluție de hipoclorit de sodiu clor activ la diferite pH
hipoclorit de sodiu în apă formează acidul hipocloros și ioni de hipoclorit în proporții determinate de pH-ul soluției. Raportul dintre ionul hipoclorit și acidul hipocloros este determinat de apariția reacției de hidroliză de hipoclorit de sodiu și de disociere acidă hipocloros (Fig. Schimbarea sub formă de soluție activă de hipoclorit de sodiu de clor, în funcție de pH-ul soluției).
Soluțiile apoase de hipoclorit de sodiu disociază într-un ion de sodiu și hipoclorit de ion:
ion Hipocloritul în mediu apos este hidrolizată:
Soluțiile apoase de hipoclorit de sodiu este instabil și se descompun în timp, chiar la temperatura normală (0,085% pe zi). Decay accelerarea iluminatului, ionii de metale grele și cloruri de metale alcaline; Dimpotrivă, sulfatul de magneziu, acid ortoboric, silicat și hidroxid de sodiu proces lent; în care cele mai stabile soluții cu un mediu puternic alcalin (pH> 11).
În mediu puternic alcalin (pH> 10), când hidroliza este suprimată ion hipoclorit, descompunerea are loc după cum urmează:
La temperaturi de peste 35 ° C, urmată de reacția de disproporționare dezintegrare:
Într-un mediu cu un indicator de pH între 5 și 10, atunci când concentrația de acid hipocloros în soluție este semnificativ mai mare de descompunere este următoarea:
HOCl + 2 ClO - = ClO3 - + 2 Cl - + H + HOCl + ClO - = O2 + 2 Cl - + H +
Cu scădere a pH-ului, atunci când nu sunt deja în soluție ClO - ion prin descompunere este următoarea:
3 HClO = ClO3 - + 2 Cl - + 3 H +2 HClO = O2 + 2 Cl - + 2 H +
În cele din urmă, atunci când pH-ul este sub 3, descompunerea este însoțită de eliberarea de clor molecular:
Vyshenapisannomu Ca un rezumat, se poate spune că la un pH mai mare de 10 de descompunere oxigenului are loc la pH 5-10 - oxigen și cloratul la un pH de 5,3 - clor și cloratul la un pH mai mic de 3 - descompunerea clorului de hipoclorit de sodiu.
soluție de hipoclorit de sodiu acidulată de acid clorhidric, clor poate fi preparat:
Hipocloritul de sodiu este un oksidatorom puternic reacționează cu multi agenti de reducere, indiferent de pH.
proprietăți biologice
Hipocloritul de sodiu are o activitate antimicrobiană marcata datorita ioni de hipoclorit. Proprietățile antimicrobiene ale hipoclorit de sodiu se manifestă deja la concentrații foarte mici, care nu au o influență organoliticheskim pronunțată. Putere mare bactericid de hipoclorit de sodiu este prezentat în soluții cu un pH aproape neutru, când concentrația acidului hipocloros și clo - ioni este aproximativ egal.
Utilizarea în stomatologie
soluție apoasă 0,5-5% de hipoclorit de sodiu în stomatologie este folosit ca material de bază pentru spălarea canalelor cu proceduri endodontice. Acest loc permite substanței să aibă efectul distructiv asupra țesutului pastă. pe substanța bio-organice și efectul său antimicrobian.
Substanțe chimice Dental
Soluția apoasă de hipoclorit de sodiu este un proces dinamic, care poate fi descrisă în conformitate cu ecuația:
NaOCl + H2O ← → NaOH + HOCI ← → Na + + OH - + H + + OCI -
PH soluție apoasă alcalină de hipoclorit de sodiu explicat formată în timpul reacției de hidroxid de sodiu, care disociază mai puternic decât acidul disociază format hipocloros.
Reacția cu substanțe bioogranicheskimi
Ca și în cazul celulozei vitale, iar în cazul necrozei pulpei într-un canal are un număr mare de substanțe bio-organice, cum ar fi proteine, grăsimi, carbohidrați, acizi nucleici.
Reacția cu grăsimi
Reacționând cu acizi grași, hipoclorit de sodiu (sau, mai degrabă, în cursul reacției de hidroxid de sodiu duplex format), le transformă în săruri de sodiu ale acizilor grași (săpun) și glicerină. Ca săpunuri și glicerol inferior tensiunea superficială a soluției rămase, care facilitează pătrunderea materiei în partea mai îngustă a canalului. Acidul hipocloros reacționează numai la locurile de legături nesaturate, în care, se adaugă unul dintre atomii de carbon de clor, și la altul - o grupare hidroxil, în care sunt formate hidrinele.
Reacția cu proteine
In timpul reacției dintre hipoclorit de sodiu și aminoacizi, hidroxid de sodiu neutralizeaza aminoacizi pentru a forma sarea de sodiu a aminoacidului, apă și chlorinates de acid hipocloros aminoacizi, dând cloramina. Acidul hipocloros reacționează cu aminoacizi cu amino laterale, amino substituit cu hidrogen în clor. aminoacizi clorurați descompun repede dacă nu sunt în proteinele din proteine care cuprind aminoacizii clorurați sunt mult mai durabile. Cu toate acestea, scăderea numărului de grupări amino din proteină datorită clorinare lor crește rata de digestie în ultimul aminoacid.
Mai mult, sa constatat că acidul hipocloros este un inhibitor eficient al grupărilor sulfhidril și în cantitate suficientă, ea poate inactiva complet proteine care conțin aminoacizi cu aceste grupuri. grupări sulfhidril Oksidiruya, acid hipocloros previne formarea de punți disulfidice care sunt responsabile pentru reticularea proteinelor. Se constată că acidul hipocloros poate oxida de 4 ori grupare amino la un sulfhidril: de 3 ori reacționează cu gruparea -SH pentru a da R-SOH, R-SO2 H și derivații H R-SO3, și timpul a 4 - cu o grupare amino în poziția alfa. Fiecare dintre primele trei intermediari pot fi condensat cu un alt grup sulfhidril și cauza proteine de adeziune.
Reacția cu acizi nucleici
Acidul hipocloros reacționează atât cu ADN și ARN, precum și cu nucleotide individuale. Reacția cu grupări NH heterociclice mai rapide decât reacția cu o grupare amino în heterociclu nu este, prin urmare, cel mai rapid reacția are loc cu acele nucleotide care au o grupare heterociclică NH - guanozina și monofosfat timidina. reacția uridinmonofosfata, care, deși este o grupă NH heterociclică, dar este foarte lent. Adenozina și tsitizinmonofosfat neavând grupare NH heterociclică reacționează laterale -NH2 grupuri suficient de lent.
Această reacție cu hipoclorit de sodiu nucleotide (acid hipocloros) în nukleokislotah previne formarea de legături de hidrogen între lanțuri polinucleotidice.
Reacția cu cadrul carbohidrat nu se întâmplă, de sprijin extern rămâne molecule intacte.
Reaction materiale dentare populare
O soluție de hipoclorit de sodiu în stomatologie adesea aplicată împreună cu alte substanțe, cum ar fi hidroxidul de calciu, peroxid de hidrogen, EDTA, acid citric, clorhexidină, și așa mai departe.
Reacția cu hidroxid de calciu
Hipocloritul de sodiu este aproape întotdeauna utilizat pentru a spăla suspensia de hidroxid de calciu din canalele, uneori, chiar și pentru atașare temporară intrakanalnogo utilizat un amestec de hidroxid de calciu și soluție de hipoclorit de sodiu, ceea ce sugerează că un astfel de amestec ar fi mai eficientă. In prezent, hidroxidul de calciu și soluție de hipoclorit de sodiu este incompatibil chimic unul cu altul, din moment ce reacționează chimic, în care hipocloritul de calciu se formează într-un hidroxid de sodiu:
În cazul în care această tehnică este spălarea suspensiei de hidroxid de calciu din canalele este justificată, deoarece hipoclorit de calciu și mai ales hidroxidul de sodiu sunt foarte ușor solubili în apă, utilizarea acestui amestec ca atașament temporar fără sens.
Reacția cu peroxid de hidrogen
soluție foarte diluată de peroxid de hidrogen este adesea utilizat în stomatologie și de multe ori lavajul sodiu canale hipoclorit alternează cu spălare cu apă oxigenată. Aceste substanțe reacționează unele cu altele, de asemenea, reacția este foarte violentă și însoțită de o evoluție rapidă a gazului (oxigen):
Aceste substanțe neutralizeze aproape instantaneu reciproc, astfel încât alternanță lor este semnificativă numai pentru neutralizarea unei soluții sau a unei reacții puternice cu degajare de gaz, care poate ajuta un pic mecanic clar canal.
Reacția EDTA
Reacția cu clorhexidina

Reacționând soluții de hipoclorit de sodiu și clorhexidină. Tuburile sunt soluție de hipoclorit de sodiu indicat concentrație în fiecare eprubetă se toarnă o soluție de clorhexidină 2%. Cele două flacoane mai potrivite sunt de control cu 6% hipoclorit de sodiu, cu numai 2% clorhexidina
Reacția de hipoclorit de sodiu și clorhexidină furnizează p-cloroanilină, care scade ca ruginiu precipitat greu solubil în apă (Fig. Reacția de hipoclorit de sodiu și clorhexidină). p-cloroanilină este toxic, cancerigen.
Reacția etanol
hipoclorit de sodiu și etanol amestecat în stomatologie rar, cu toate acestea, unii stomatologi cred că adăugarea de etanol la o soluție de hipoclorit de sodiu, va reduce tensiunea superficială a acestuia din urmă. In prezent, hipoclorit de sodiu chlorinates etanol cloroform. astfel încât amestecarea acestor substanțe nu este de dorit în cazul în care nu există nici un scop pentru a obține exact cloroform.
Hipocloritul de sodiu se oxidează mai întâi etanol la acetaldehidă și apoi se transformă în cloral (tricloracetaldehida):
Într-un mediu alcalin descompune cloral pentru a forma cloroform și sarea de sodiu a acidului formic:
Reacția cu oxid de zinc
Oxid de zinc se găsește în multe materiale dentare, cum ar fi etanșarea temporară sau fixarea materialelor sealers endodontologicheskie și ace guttaperchievye. În soluții de hipoclorit de sodiu cu hidroxid de sodiu, este întotdeauna prezent. și care poate reacționa cu oxid de zinc, conform reacției următoare:
Reacția cu acid clorhidric
Acidul clorhidric este utilizat în stomatologie foarte rar, cu toate acestea, reacția de hipoclorit de sodiu cu acid clorhidric are loc:
reacție violentă, însoțită de o izolare de eliberare intensă bruscă a clorului la momentul amestecării și continuă o anumită perioadă de timp.