halogenuri de argint - enciclopedia chimică 1
halogenură de argint. Compoziție fluoruri AG2 F, AgF și AgF2 și colab. haloaenuri compoziție AGX (vezi. Tabel.).
Gemiftorid AG2 F, atunci când încălzirea. peste 90 ° C, iar când se dizolvă în apă, se descompune cu formarea AgF și Ag; diamagnetic; m. b. obținut prin iradiere UV AgF. Fluorul AgF higroscopică; solubilitate bună. în apă (172 g per 100 g la 20 ° C); Sistemul AgF-H2O temp eutectic -14,2 ° C (37,5% în greutate AgF); până la 18.6 ° C, în echilibru cu p-rom (62,9% în greutate AgF) este AgF tetrahidrat · 4H2O (-1387,8 kJ / mol, -1,145.6 kJ / mol) până la 39,5 ° C (68,95% AgF) -digidrat AgF · 2H2O (-801,6 kJ / mol, - 669.9 kJ / mol), 39,5 ° C peste sare anhidră. AgF2 biflorură se descompune pentru a forma apa AgF, HF, O2 și O3 impurități.
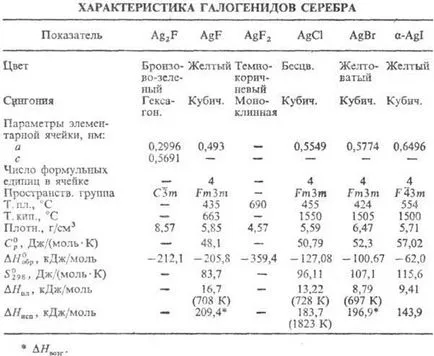
Chloride (hlorargirit mineral sau cerargyrite, corn de argint) AgCl în fază gazoasă este sub formă de mono-, di și nu molecula trimeric sol. în apă (produs de p-ri-PUNTE 1,8 x 10 -10) sol. la sfârșitul anului. H N O3.
Bromura (bromargirit mineral) AgBr până la 259 ° C, există în cub. cristalin. modificarea, peste 259 ° C în rombich.; nici un sol. în apă (produs de p-rimosti 5,4 x x 10 -13).
Lodură (iodargirit mineral) Agl există în mai multe. cristalin. modificări: până la 136 ° C este stabil un -Agl, în intervalul 136 - la 147 ° C-hex. b forma a (a = 0.4596 nm, c = 0,7500 nm, z = 2, spații. Grupa F 63 n) peste 147 ° C cubi. g-modificare; nici un sol. în apă (produs de 8,5 × 10 -17-p rimosti) sol. în etanol.
C., solubilitatea. excesul de halogenura TION corespunzătoare complexelor m-halogenură pentru a forma, ele sunt, de asemenea, sol. o p pax cianurile și tiosulfaților metalelor alcaline și amoniac apos pentru a forma complex de ioni de Ag. C. a fost redus la săruri anorganice Ag. (Pb, Zn, Mg, H2) și org. (Hidrazina, formaldehida, hidrochinonă, și altele asemenea) agenți de reducere. Sub efectul luminii se descompun cu eliberarea de Ag °; sensibilitate AgF mai mare decât cea a AgCl.
C. a fost obținut interacțiune. Ag și halogeni, în prezența. apă, precum și prelucrarea de Ag conc. ramie Water p-halo-m-burly și să facă schimb de interacțiune. între p - sare solubilă a Ag și halogenură metalică corespunzătoare.
Pentru regenerarea Ag dec. C. Deșeurile sunt utilizate, alierea cu carbonați ai metalelor alcaline. C. g (AgCl, AgBr, AgI) este utilizat pentru a prepara svetochuvstvit. emulsii în producție-ve de film și materiale fotografice. Deoarece elementele AgCl fabricate optice pentru spectrometre de infraroșu, detectoare cosmice. radiații. AgBr-catalizator în prepararea anumitor carboxilic k-m. AgF, AgI și dublu ioduri de metale alcaline și Ag au o conductivitate ridicată de ioni în stare solidă și sunt utilizate pentru producerea de electroliti solizi și senzori. AgF, de asemenea, utilizat ca o componentă a fosforescente și agentul de fluorurare în org. sinteza, AgI cu galvanic. argintat, pentru a forma iskuss de ploaie și zăpadă din nori de furtună. P. M. Chukurov.
===
App. Literatura pentru articolul „halogenură de argint“. necunoscut
Pagina „halogenură de argint“ preparate pe baza Encyclopedia chimice.