halogeni - Obtinere studopediya
Fluorul este produs prin electroliza anhidru (ca fluor reacționează cu apa) HF în topit KHF2 bifluorura de potasiu:
oxidarea clorului a fost preparat în laborator de acid clorhidric concentrat:
În lene industrială - electroliza clorurii de sodiu:
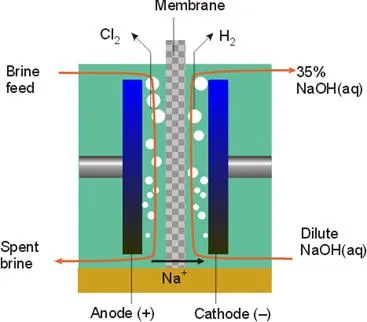
Există 2 moduri de electroliza - si membrana diafragma.
Diafragma Metoda de producție de clor este cel mai eficient energetic, dar complexe în organizare și funcționare.
In electrolizoarele moderne catod și spațiu anod sunt separate printr-o membrană schimbătoare de anioni polimeric. Membrana permite cationi de Na + să treacă din compartimentul anodic în catod. Cationii electroneutralității Daylight sprijină pe ambele părți ale electrolizorului, deoarece în timpul electrolizei ionii negativi sunt îndepărtați de la anod (conversie 2CI - în Cl2) și se acumulează la catod (formarea OH -). Mutarea OH - în direcția opusă ar putea menține neutralitatea electrică, dar ion OH - ar reacționa cu Cl2 și negată întregului rezultat.
Compartimentul de anod este furnizat fluxul de soluție de sare și catod - apă deionizată. Din spațiul catodic este anolitului flux sărăcit care conține aceeași ioni de impurități gipohlorit- și clorurati și este clor, iar anodul - alcalin și hidrogen, conținând în mod substanțial fără impurități și o concentrație apropiată de produs, ceea ce reduce costurile de energie de evaporare și purificare.
Soluția de sare de alimentare (atât proaspete, cât și circulant) și maxim de apă pre-curățat de orice impurități. Această curățare este determinată de costul ridicat al membranelor schimbătoare de cationi polimerice și vulnerabilitatea acestora la impuritățile din soluția de alimentare.
In industrie, brom și iod este produs prin clorinarea apei de mare (de apă și unele lacuri sărate)
laborator (rar) preparat prin oxidarea cloruri și bromuri:
sau clor prin deplasarea sărurilor:
Proprietăți chimice halogeni
Fluorul este chimic extrem de activ, acesta este cel mai puternic oxidant. Atmosfera de fluor chiar arde și apă de sticlă, azbest și cărămizi:
Unul dintre produsele de combustie este oxigen, adică fluor este un oxidant mai puternic decât oxigenul.
Fluor oxidează gazele „nobile“:
Clorul este, de asemenea, un agent oxidant puternic, reducând proprietățile afișează numai cu fluor. Poate disproporționată:
Interacțiunea cu substanțele simple de halogen:
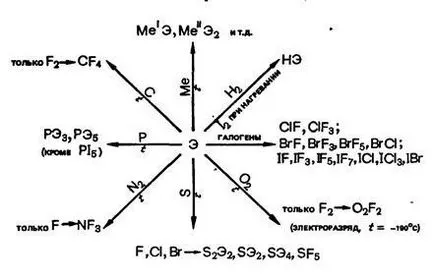
Interacțiunea cu reactivi cheie halogen:
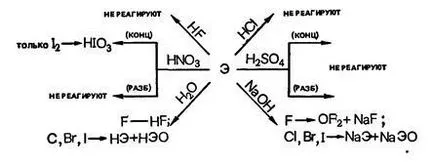
Bromul și clor sunt solubile în apă și, parțial, să reacționeze cu acesta pentru a forma o așa-numită „apă bleach“ și „apă de brom.“
Iodul este practic insolubil în apă și nu este capabil să oxideze chiar și atunci când este încălzit; Din acest motiv, nu există nici o „apă de iod.“
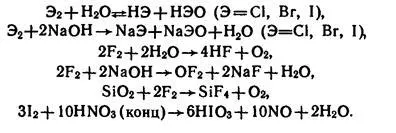
Halogenuri Hhal - gaze (cu excepția HF), bine solubili în apă.
Caracteristicile generale ale halogenhidrici:
Printre HF-HCl-HBr-HI H-E o rezistență a legăturii scade, crește rezistența acide, reducând crește puterea.
Printre HF-HCl-HBr-HI momentul dipol scade, dar crește polarizabilitatea a moleculelor, deci se topește și la fierbere creșterea temperaturilor.
Puternic polar molecula HF () formează asociați datorită legăturilor de hidrogen. Prin urmare, HF în contrast cu alte halogenuri de hidrogen este un lichid. Chiar și în stare gazoasă HF se compune din polimeri (HF) n. n = 2-6.
Din cauza moleculei puternice de interacțiune HF intermoleculară disociază conform schemei:
H-F # 8729, # 8729, # 8729, H-F # 8729, # 8729, # 8729; H-F ↔ [H-F-H] + [F-H-F] -
sau H-F # 8729, # 8729, # 8729, H-F # 8729, # 8729, # 8729; H-F ↔
Metode pentru producerea galogenovodorov:
HF se obține din fluorină cu acid sulfuric concentrat:
HCl în industrie a fost preparată prin sinteză din substanțe simple de:
In laborator, HCl a fost preparat din cloruri:
HBr preparat prin reacția:
HI este preparată prin hidrolizarea PI3 iodură de fosfor și reacția:
În reacția HF c alcaline difluorură formate:
fluorura de hidrogen și acid fluorhidric și distruge sticla de cuarț:
fluorhidric lichid este un bun solvent dizolvă în apă, fluoruri, sulfați și nitrați s-I Elemente de grup și s-a II ușor mai rele elemente de grup.
- acizi puternici (cu excepția HF, este puternic numai în formă pură)
studii disocierea # 945; în soluții 0,1 M de acid, la 18 ° C: