gruparea carboxil
Conține grupe alcool și cetonă primare adiacente.
Deoarece electronii sistem de interfață în curs de dezvoltare, grupul -ketolnaya posedă proprietăți puternice reducătoare (mai puternice decât alcoolii primari convenționali și cetone). Oxidized aceiași reactivi ca și aldehide (vezi „Aldehide“, n 1 ..) oxidarea cu conform schemei:
Exemplele LOS conținând grupa -ketolnuyu: cortizon, hidrocortizon, dezoxicorticosteronul, prednison, și altele.
1. Acid-bazic. Gruparea carboxil prezintă proprietăți acide destul de puternice. Acid pKa de aproximativ 4,7 - 4.8. Lungimea radicalului nu are practic nici un efect asupra rezistenței proprietăților acide. Introducerea de hidrocarburi substituenți radicali sau ciclu atrăgători de electroni (halogeni, gruparea hidroxil, gruparea nitro, gruparea carboxil mai mult) crește semnificativ (1 - 2 - 3 unități de pKa) grupare acidă carboxil.
În soluție, gruparea carboxil este supusă la ionizare, formează ion carboxilat (anion al acidului corespunzător) și proton. ion carboxilatul prezintă proprietăți de bază (o bază slabă). Acizii carboxilici formează sare, prin reacția cu hidroxizi, carbonați și bicarbonați ai metalelor alcaline (sodiu și potasiu) și săruri de amoniu. Aceste săruri sunt în general ușor solubile în apă, sunt incolore. Gruparea carboxil în formă de anion (adică sub formă de sare) reacționează cu săruri de metale grele (cupru, fier, cobalt). Efectul reacției - formarea de săruri cu solubilitate redusă în apă. Culoarea Pictura este determinată de medicament și reactiv. Sărurile de cupru sunt colorate albastru-verde, fier - galben-roz, cobalt - în roz.
2.Eterifikatsiya cu alcooli (vezi. "Hidroxil alcoolice", p.1).
reacția de autentificare
1. Reacția de formare a esterilor (esterificare).
Metodologie. Aproximativ 0,02 g de substanță medicamentoasă (acetat, acid benzoic de potasiu, acid acetilsalicilic, acid nicotinic) a fost plasată într-un flacon uscat, se adaugă 2 picături de alcool de 95%, 5 picături de acid sulfuric concentrat și amestecul este încălzit cu precauție; M-am simțit esteri miros.
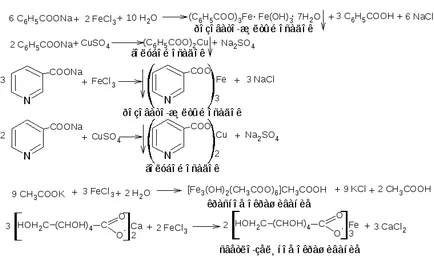
2. Reacții cu săruri de metale grele.
Caracteristici ale reacțiilor:
substanța medicamentoasă reacționează numai în formă ionizată, deci este mai întâi transformat în sarea de sodiu (sau amoniu). Mediul de reacție ar trebui să fie aproape de neutru, astfel încât alcalin este luată într-o cantitate echivalentă (fără exces). Într-un mediu alcalin reactivi precipitat sub formă de hidroxizi cu substanța medicamentoasă nu reacționează.
Reacțiile acestui grup sunt insensibili, așa că este necesar să se prepare o soluție concentrată a medicamentului (de obicei 2-5%).
Metodologie. 2.1. Aproximativ 0,15 g de medicament (acid benzoic, acid nicotinic) este agitat cu 3 ml soluție de hidroxid de sodiu (0,1 mol \ L), se filtrează (filtratul poate fi adăugat în 1-2 ml de apă). Filtratul a fost împărțit în două părți. Prima porțiune a fost adăugat 2 picături de soluție de clorură de fier (III), în al doilea - 2 picături de soluție de compus (II) sulfat de cupru; reacție efecte observabile.
2.2. Aproximativ 0,05 g de substanță medicamentoasă (acetat de potasiu, gluconat de calciu) se dizolvă în 2 ml de apă, soluția a fost împărțită în două părți. Reacția este efectuată cu reactivii de mai sus, observa efectul reacției.
determinarea cantitativă
Metoda de neutralizare 1.Alkalimetrichesky. Pe baza proprietăților puternic grupării carboxil acidă. Titrant - soluție de hidroxid de sodiu. - indicator fenolftaleină (pH interval de tranziție de culoare 8,2- 10,0, deci sunt ideale pentru titrarea acizilor carboxilici). Medicamentele insolubile în apă, dizolvat în prealabil într-un solvent organic (alcool etilic, cel puțin - acetonă).
fekv (acid salicilic) = 1
2. Determinarea sărurilor de sodiu și potasiu ale acizilor carboxilici.
ion carboxilatul prezintă proprietăți bazice slabe, metoda acidimetric așa folosită. Soluția apoasă este titrat dificil.
2.1. Metoda de titrare acido-bazic într-un mediu Protogenov dizolvat
ERATOR. consolidând proprietățile de bază slabe ale ionului carboxilat. Solventul este glacial titrant acid acetic - soluție de acid percloric în acid acetic glacial, indicatorul - soluția violet cristal în acid acetic glacial.
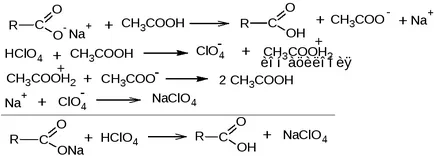
fekv (substanță) = 1 / n, unde n - numărul ionilor carboxilat în substanță.
2.2. neutralizare Metoda acidimetric (deplasare). Folosit pentru a determina sărurile acizilor carboxilici în formulările produse extemporaneu. Titrant - acid clorhidric. Indicatorii PH cu un interval de tranziție de culoare de aproximativ 2 (albastru timol, galben dimetil). În titrare în prezență de portocală metil (pH 3,0 - 4.4) trebuie adăugat eter, care extrage acidul carboxilic rezultat, și astfel deplasează reacția de echilibru la dreapta.
fekv (salicilat de sodiu) = 1
(PKa 2,89; pH 3 să fie titrați doar 50% din compus, extract de ester acid salicilic, obținându-se astfel aproape 100% Conversia sării la acid).