Geometria moleculei ca o cheie pentru înțelegerea proprietăților substanțelor
Clasa 9 "m", școală Sfax № 197 din Ekaterinburg
Chilikova Svetlana Alekseevna
Geometria moleculelor este direct legată de structura unui atom. Noțiunea de structura spațială a moleculelor de substanțe importante pentru chimie, în general, ca o știință care studiază substanțele, proprietățile lor, metodele de preparare și utilizare.
În plus, reprezentarea structurii spațiale a moleculelor de a dezvolta gândirea abstractă și spațială, care este deosebit de relevant în contextul științei moderne și dezvoltarea tehnologiei.
Din păcate, aceste lucruri este fie afișat pentru cadru de învățământ, sau pentru a studia este dat un pic de timp.
Înțelegerea relației dintre structura moleculară și proprietățile substanțelor logice stabilește relația fenomene extern destul de diferite, și ajută la formarea gândirii științifice.
În această lucrare, am încercat să analizăm relația dintre structura spațială a moleculelor de apă și metan și proprietățile lor fizice și chimice.
Apa - o substanță a cărei principală structurală unitate este o moleculă de H2 O. Conform conceptelor moderne ale structurii atomice, în al doilea - exterior - strat atom de oxigen electronic este șase electroni, configurație electronică notată 1SS 2 2p 4. Pe hibridizarea teoriei orbitali atomice și metoda de valență obligațiuni, o pereche de valență nepereche 2p-electron atomului de oxigen într-o stare de hibridizare sp 3 este reacționat cu fiecare dintre 1s-electron a doi atomi de hidrogen, pentru a forma o moleculă de apă. Celelalte două sp 3 -Hybrid orbitalii atomului de oxigen are două perechi de electroni, care nu sunt implicate în formarea legăturii. Toate cele patru perechi de electroni ocupa o anumită zonă în spațiul din jurul atomului de oxigen central în moleculă. Datorită repulsiei electrostatice reciproce între lipirea și perechile de electroni nonbonding, o molecula de apa are o formă simetrică. Fig. 1 este o diagramă a suprapunerii orbitali de electroni de atomi de oxigen și hidrogen în formarea unei molecule de apă.
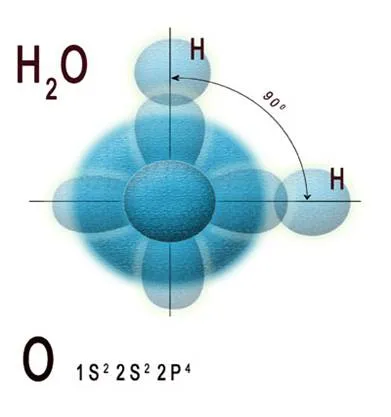
Figura 1. Schema suprapunerii orbitali de electroni de atomi de hidrogen și oxigen în molecula de apa
Molecula de apă are o structură care seamănă cu un triunghi isoscel, al cărui apex este un atom de oxigen, iar în partea de jos - doi atomi de hidrogen. Unghiul la vârf este de 104 ° 27“, iar lungimea laturii - 0,096 nm. Acești parametri se referă la o stare de echilibru ipotetic al moleculelor de apă, fără oscilații și rotațiile sale [1]. Schematic, structura moleculei de apă este reprezentată în Figura 2.
Molecula de apă este un dipol cu poli încărcate pozitiv și negativ. Dacă presupunem că este posibil să se pună într-un câmp electric al unei singure molecule de apă nu este asociat cu alte molecule, atunci se va transforma polii negativi în direcția electrodului pozitiv și terminalele pozitive - spre negativ.
Figura 2. Diagrama unei molecule de apă
Dacă vă conectați prin linii drepte epicenters de sarcini pozitive și negative ale moleculei de apă, veți obține volumul figura geometrică - un tetraedru regulat.
Deoarece molecula de apă este asimetrică, centrele de greutate al sarcinilor pozitive și negative nu coincid. Moleculele de apa au doi poli - pozitiv și negativ. Ele sunt ca un magnet, de a crea un câmp de forță moleculară. Astfel de molecule sunt numite polar sau dipolii (Fig. 3) [2].
Figura 3. Bulk orbitali hibrid aranjament de circuit în molecula de apă
legături cu hidrogen ca o formă de asociere între un atom de oxigen electronegativ al unei molecule de atomi de hidrogen si alte molecule responsabile pentru multe din proprietățile unice ale apei. Energia legăturii de hidrogen semnificativ mai puțină putere de obicei legături covalente (mai mică de 40 kJ / mol). Cu toate acestea, această energie este suficientă pentru a determina asocierea moleculelor, adică asocierea lor în dimeri sau polimeri [2]. Deoarece o moleculă de apă poate forma până la patru legături de hidrogen clasice cu molecule vecine, adică numărul de legături de hidrogen explică capacitate anormal de căldură mare de apă, punctul său de fierbere relativ ridicat, viscozitate ridicată și tensiunea superficială.
Din varietatea structurilor din natura bazei este hexagonal structura (hex) în cazul în care șase molecule de apă (tetraedre) sunt combinate într-un inel (Fig. 4 b) [5].
Noi încercăm să analizăm relația dintre proprietățile apei și caracteristicile sale structurale ale moleculelor. Tabelul 1 prezintă rezultatele comparației. După cum se vede din tabel că apa are valori anormale ale proprietăților fizice, ceea ce este, probabil, o consecință a caracteristicilor structurii materiei.
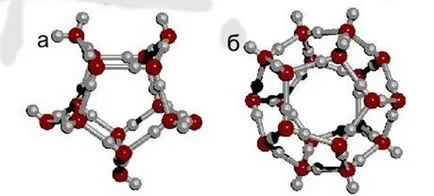
Figura 4. Clustere de apă
Proprietățile fizice ale apei [4].
Luați în considerare structura unei alte substanțe. Metanul - cea mai simpla hidrocarbura, a cărui formulă chimică este CH4. Ca molecula de apă, substanța constă dintr-un element asociat cu un număr de atomi de hidrogen. Dar, compoziția similaritatea moleculelor de metan și apă, proprietățile acestor materiale sunt diferite.
Să încercăm să găsim o explicație pentru acest fapt în particularitățile structurii moleculei de metan [3].
Atomul de carbon din stratul de electroni exterior 4 are un electron, electroni formula 1ssp 2. Se pare că aici ne confruntăm cu un conflict - sunt singurul nepereche de electroni 2 p, și s-electronii sunt asociat, dar toate legăturile chimice C-H din molecula metan sunt identice în lungime și energie. Deoarece legăturile chimice, de obicei instalate în detrimentul moleculei de metan electroni nepereche ar trebui să fie cu formula CH2. ceea ce nu este adevărat. Această contradicție este eliminată prin tratarea formării legăturilor chimice datorită orbitalii electronice hibridizate.
Când atomul de carbon reacționează cu atomii de hidrogen, cuplat s-electroni stratul exterior separat, unul dintre ele ocupă un spațiu pe p-orbital și mișcarea formează un nor sub forma unui volum de opt perpendicular în raport cu nori de două alte p-electroni. Atom într-o stare excitată și electroni formula poate fi scris ca 1 1SS 2p 3.
Acum, toate cele patru electroni de valență sunt nepereche și pot forma patru legături chimice.
În acest caz, o nouă contradicție. Teoretic, trei p-electron trebuie să formeze legături chimice cu trei atomi de hidrogen în direcții reciproc perpendiculare, adică. E. Un unghi de 90 °, iar al patrulea atom de hidrogen poate fi conectat într-o direcție arbitrară, deoarece norul s-electron este sferic. Astfel de conexiuni ar diferi în mod evident, în proprietățile lor. În același timp, se știe că toate legăturile C-H din molecula de metan sunt identice și sunt dispuse la un unghi de 109 ° 28“. Pentru a explica această contradicție face conceptul de hibridizare a orbitalii de electroni de atomi de carbon, - amestecarea și egalizarea formei orbital și energie (Figura 5.).
Figura 5. Hibridizarea orbitali de electroni de atomi de carbon în molecula de metan
Deci, metan patru orbitali hibrizi de atomi de carbon în spațiu formează o figură geometrică tetraedru, unghiurile dintre axele legăturile C-H sunt egale 109 ° 28“. O astfel de stare de valență este numit atomi de carbon sp3 -gibpidizatsiya. Dispunerea spațială a atomilor într-o moleculă de metan poate fi demonstrat folosind modele tetraedrice și sharosterzhnevyh. Figura 6 prezintă modelul sharosterzhnevye molecula de metan. După cum se vede din figură, modelul se potrivește în molecula de metan tetraedrul [7].
Figura 6. Sharosterzhnevye molecula model de metan
Tabelul 2 prezintă proprietățile fizice ale metanului. După cum se vede din datele prezentate, non-polaritatea moleculei de metan este cauza legăturilor intermoleculare slabe, ca o consecință - temperaturile scăzute de fierbere și topire.
Proprietățile fizice ale metanului.
Comparând structura moleculelor de apă și metan și proprietățile sale, putem trage unele concluzii.
Molecula de metan și o moleculă de apă, formează un spațiu în tetraedru. Cu toate acestea, moleculele de apă, spre deosebire de molecula de metan are polaritate. Orbitali hibrid de electroni exterior carboni strat blocat orbitalii atomilor S- hidrogen și toate cele patru legături chimice echivalente [6].
Polaritatea moleculelor de apă determină posibilitatea formării de legături de hidrogen între moleculele de apă, ceea ce duce la proprietăți fizice și chimice specifice ale apei. Fiecare moleculă de apă ca un magnet mic atrage din cauza formarea de punți de hidrogen patru molecule. Pe măsură ce apa se evapora distrugerea a numeroase legături de hidrogen necesită multă energie, și ca rezultat - o valoare mare a tensiunii superficiale. Punctul de fierbere ridicat este o consecință a căldurii specifice ridicate de vaporizarea, care la rândul său este cauzată de distribuția neuniformă a densității de electroni în molecula de apă.
moleculele de metan sunt nepolară și relativ slab interacționează unele cu altele. Din cauza acestui lichid metan se evaporă la temperaturi foarte scăzute. Moleculele de gaz metan nu pot asambla structura stabila si este metanul gazos. moleculele de metan nepolare explică, de asemenea, faptul că metanul este un solvent slab.
Astfel, putem concluziona că este structura moleculelor de metan și apă determină o diferență între proprietățile lor și, prin urmare, se poate presupune că proprietățile oricărei substanțe este direct dependentă de structura moleculelor. Înțelegerea fundamentelor teoretice ale structurii materiei este cheia pentru o înțelegere a proprietăților, dezvoltarea de metode pentru prepararea și utilizarea substanțelor de către oamenii de știință moderni.
2.Gillespi P. Geometria moleculelor. București, Ed. "Mir", 1975, 282 p.