Formula amoniac în chimie
Amoniacul - este un compus anorganic de hidrogen și azot, cu un grad de oxidare a azotului.
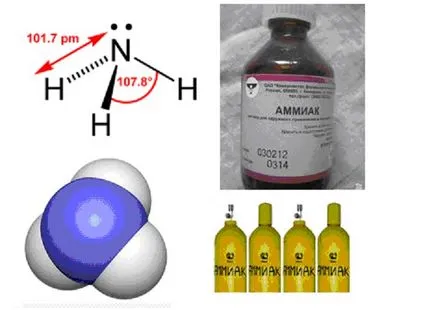
Masa moleculară este g / mol.
Proprietățile fizice - Amoniacul este un gaz incolor, cu un miros ascuțit, punctul de topire, punctul de fierbere, este bine solubil în apă (la 30 ° C, cu o densitate de masă de 0,892 g / ml), alcool și un număr de alți solvenți organici.
Proprietățile chimice ale amoniacului
- prezintă proprietăți amfoteri (proprietăți acide foarte slab), prin urmare, reacționează cu metale alcaline cu acizi, cu agenți oxidanți cu ioni metalici de tranziție:
Prepararea amoniacului
Amoniac obținută direct la scară industrială prin reacția dintre hidrogen și azot, în prezența diferiților catalizatori (platină, nichel, fier):
In laborator, amoniacul produs prin acțiunea alcalină puternică asupra sării de amoniu prin încălzire:
cerere
Amoniacul este folosit pentru a produce îngrășăminte cu azot, explozivi, diverși polimeri utilizați în producția de acid azotic, sodă și alte produse chimice găsi aplicații în medicină ca un agent patogen respirator loțiunile stimulator de vomă. amoniac lichid este utilizat ca solvent.
reacție calitativă
reacție calitativă a amoniacului este de cotitură hârtie de turnesol albastru umezită cu apă. Altă reacție calitativă a amoniacului - este formarea unui precipitat galben-brun când reacționează cu amoniacul reactiv Nessler:
Exemple de rezolvare a problemelor
Se calculează constanta de echilibru a reacției de dizolvare a soluției de amoniac precipitat din cauza formării de complexe.
Noi scrie ecuațiile reacțiilor:
Scriem reacția de masă de constantă și se calculează magnitudinea acestuia:
- produs de solubilitate
- constanta instabilitate
1 litru de gaz în condiții normale și care conțin impurități de absorbit ml indiferent de soluție cu o molaritate de 1 mol / l. Excesul de soluție se titrează cu 20 ml dintr-o molaritate de 0,1 mol / l. Se determină fracția de volum a amestecului de gaz.
Noi scrie ecuațiile reacțiilor:
Calculăm numărul inițial de moli.
Calculati un număr mare de moli:
Găsiți numărul de moli, care a continuat absorbția:
Se calculează numărul de moli și volumul:
- volumul molar al unui gaz ideal în condiții normale.
Se calculează fracțiunea de volum: