Energia internă, dependența de energia internă a parametrilor macroscopice, locul de muncă
Din punct de vedere al teoriei moleculare cinetice a energiei interne (J) - reprezintă suma energiei potențiale de interacțiune a particulelor care alcătuiesc corpul, iar energia cinetică a mișcării termice aleatoare. Energia cinetică a mișcării aleatoare a particulelor este proporțională cu temperatura T, energia potențială a interacțiunii depinde de distanțele dintre particule, adică, volumul V al corpului. De aceea, termodinamica U energie internă a corpului este determinată ca funcție de temperatură T și V. obelsja
Dacă orice procese într-un sistem termodinamic izolat energie internă rămâne neschimbată: sau.
Energia internă este definită de starea termodinamică a sistemului și nu depinde de modul în care sistemul a fost în această stare. Prin urmare, energia internă nu este conectat cu procesul sistemului este schimbat. Două sau mai multe din aceeași stare de energie internă a sistemului este aceeași.
De interes practic nu este internă a energiei și modificarea acesteia în timpul trecerii de la o stare la alta. Dacă energia potențială a interacțiunii moleculelor este zero, energia internă a unui gaz ideal este egală cu suma energiei cinetice a mișcării moleculelor sale. Energia interna a unui gaz ideal este direct proporțională cu temperatura absolută. În consecință, atunci când schimbă temperatura ideală a gazelor este necesar să se schimbe energia sa internă.
în care R - este constanta universală a gazelor, M - masa molară, T - temperatura absolută, t - greutatea - numărul de molecule.
Energia interna a unui gaz ideal depinde de un parametru - temperatura. Din volumul intern al unei energii gaz ideal este independentă deoarece energia potențială a moleculelor sale este considerat egal cu zero.
In gazele reale, lichide și solide medie energie potențială a interacțiunii dintre molecule nu este zero. Energia potențială medie de interacțiune a moleculelor depinde de volumul de material, deoarece schimbarea volumului se modifică distanța medie dintre molecule. Prin urmare, energia internă, în termodinamică, în cazul general, împreună cu temperatura T și depinde de V. volumul
U energia internă a corpului macroscopic este unic parametrii determinați ce caracterizează starea acestor corpuri ca temperatură și volum.
Energia internă poate schimba în două moduri: performanța de muncă, atunci când schimbările interne de energie cu o valoare egală cu forțele externe A și transferul de căldură în care variația în energia internă este caracterizată printr-o cantitate de căldură Q.
Atunci când se efectuează modificări de volum de lucru ale corpului și viteza este zero. Dar viteza moleculelor corpului, cum ar fi schimbarea de gaz. Prin urmare, modificările și temperatura corpului.
Deci, atunci când se lucrează în starea modificărilor termodinamice ale corpurilor macroscopice: schimbarea volumului si temperaturii lor.
F „- forța cu care presiunea gazului asupra pistonului;
F - forța cu care apasă pistonul pe gaz;
O „- munca prestată de gaz asupra organismelor externe;
A - lucrul mecanic efectuat asupra gazului de către organismele externe.
1. dilată gaz
în cazul în care - pentru a modifica volumul.
Gaz tradeaza energie corpurile din jur și se răcește.
2. Gazul comprimat
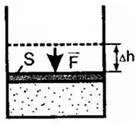
Gazul este alimentat de organisme externe și este încălzit. Semnul minus indică faptul că gazul este comprimat atunci când. activitatea forței externe este pozitiv.