Electrozii și potențialul
Electrozii și potențialul
O secțiune importantă a chimiei moderne este electrochimie, care studiază procesele care au loc la metale conductoare transfrontaliere cu lichide sau gaze. În aceste procese trebuie să participe particule încărcate, ioni și electroni. Electrochimie este de o mare importanță practică: Prepararea și purificarea metalelor, aplicarea acoperirilor de protecție, fabricarea de copii metalice, prepararea unui număr de substanțe chimice (alcaline, clor si multe altele), construcția de surse de curent chimice - toate bazate pe procese electrochimice
Electrozi. Electrod electrochimie numit un sistem, în care un material conductor este plasat în soluția de electrolit sau topi sau în gazul. Metalul solid (sub formă de bucăți, plăci, sârmă, pulbere, cu un singur cristal), metalul lichid (mercur, se topește din metal, amalgamele mercur aliaje), diverși compuși (oxizi, carburi, etc.) pot fi utilizate ca material conductor, materiale nemetalice ( carbon, grafit, etc.), semiconductori.
Cel mai simplu exemplu de metal, plasate în această soluție apoasă de sare de metal; aceasta se numește electrodul 1 al primului tip.
Luați în considerare acest exemplu: placă de cupru este cufundat într-o soluție de sulfat de cupru (II). Sarea în soluție apoasă disociază în ioni:
SuS04 ---> Cu 2+ + SO4 2-
La imersia plăcii în soluție poate avea loc două procese: cupru de metal de tranziție cu atomii de suprafață din soluție (un proces de oxidare):
Cu - 2e ---> Cu 2+:
și recuperarea ionilor metalici: Cu 2+ + 2e ---> Cu
De obicei, cele două procese au loc simultan, dar viteza de una dintre ele, la momentul inițial mai lung. Foarte repede (a doua split) viteza ambelor procese sunt aliniate și se stabilește un echilibru între ionii metalici în soluție și un metal:
Cu 2+ + 2e ---> Cu
Astfel, dacă electrodul nu oferă influențe externe, este sistemul de echilibru.
Pentru electrozii 1 al doilea tip sunt toate tipurile de sistem Me z + + ze ---> Me (unde Me-un metal, z-charge ionilor metalici), precum și sisteme cu electrozi din amalgam; amalgam (soluție de metal în mercur) -ions metal. De exemplu, amalgam de zinc ionilor de zinc:
Zn 2+ + 2e ---> Zn (Hg)
Există și alte tipuri de electrozi. În cazul în care stratul metalic este aplicat sarea sa solubilă sau oxid și plasate într-o soluție care conține ioni de sare (pentru ionii de oxid de OH-), atunci sistemul va electrod 2 din primul tip. De exemplu, acoperite cu clorură de argint AgCl film și plasat într-o soluție de clorură de potasiu de argint este un electrod de clorură de argint. echilibrul este stabilit într-un astfel de sistem:
AgCl + e <---> Ag + Cl -
Un electrod comun al doilea tip este electrodul de calomel așa cum este prezentat în Fig. 1 Pentru producerea unui astfel de sistem este turnat mercur (1) într-un vas de sticlă plasată pe ea clorură mercurică (2) (calomel) - și se toarnă o soluție de clorură de potasiu (3). Prin sistem atașat la electrod de contact metalică (4), care este imersată în mercur de măsurare.
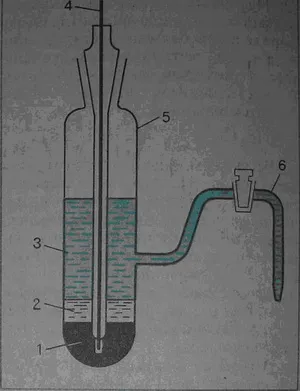
Fig. I. electrod de calomel 1 mercur-2-calomel, 3-o soluție de clorură de potasiu, contactul 4-metal, recipient de sticlă 5, punte 6-sare
Echilibrul electrod de calomel este stabilit:
Hg2 C12 + 2e<=> 2 Hg + 2 Cl -
Unele materiale (platină, grafit) sunt numite inerte, astfel încât acestea nu pot trimite ionii lor în soluție. Astfel de materiale sunt utilizate pentru redox sau redox electrozi cos-Danemarca. De exemplu, o placă de platină imersat într-o soluție care conține sulfat de fier (II) sulfat și fier (III). In acest sistem, ionii Fe2 + se va apropia de metal inert și dona electroni pentru ea:
Fe 2 + - e ---> Fe + 3
Ionii Fe3 +, se apropie de metal Bu FLS accepta electroni de la ea:
Fe3 + + e ---> Fe + 2.
La acest electrod se stabilește un echilibru:
Fe 3+ + e <--->Fe + 2
Auto material de electrod inert într-un sistem de echilibru nu acceptă decât participarea indirectă - este un conductor de electroni.
Echilibrul redox la electrodul poate participa un număr mai mare de particule. De exemplu, dacă un electrod de platină este cufundat într-o soluție de permanganat de potasiu acidifiat, se stabilește echilibrul:
MnO - 4 + 8H + + 5e ---> M n + + 4H2 2 0
Un tip special de electrozi redox sunt gaz elektrdy, în care una dintre substanțele active este gaz. gaz electrod EXEMPLU - electrod de hidrogen: platină, a scăzut într-o soluție care conține ioni de hidrogen H + (soluție acidă), prin care un gaz de hidrogen
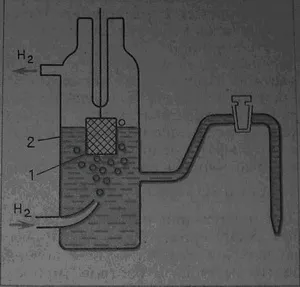
Fig. 2. Electrod pH: platină-1, acid 2-
Soldul total pe un astfel de electrod este exprimată printr-o schemă simplificată:
2H + + 2e ---> H2
Luați în considerare mai detaliat circuit. hidrogen molecular, care trece printr-un lichid, dizolvat și soluția pe suprafața de platină (1). Pe suprafața metalului apar molecule de dezintegrare în atomii și adsorbția lor (legare la suprafață). Atomii de hidrogen adsorbiți sunt SDAS ionizate:
SDAS -e ---> H +
și ioni de hidrogen, luând electronii trec într-o stare adsorbită:
Circuit Astfel, un echilibru deplin în electrodul de hidrogen este exprimat
2H + + 2e ---> H2
Toate aceste tipuri de electrozi sunt sisteme redox, deși numele (electrozi redox) este doar o parte din ele. Deci, în sistemul
Cu2 + + 2e ---> Cu redus formă sau un metal reducător este cupru, iar forma oxidată sau comburant - ionii de cupru Cu 2+.
Sistemul AgCl + e ---> Ag + Cl - oxidate formă - AgCl și restaurat - Ag + CI -; formează un electrod de hidrogen de hidrogen ioni sunt oxidate, gazos-reducere, etc.
utilizate în mod frecvent o practică standard în electrozi electrochimice astfel standard de hidrogen. Funcționarea acestor electrozi are loc în condiții standard: temperatură de 298 K (25 ° C), o presiune de 101325 Pa (° sau 760 mm Hg sau 1 atmosferă ..) și concentrațiile tuturor componentelor din soluția I mol / L.
În industrie, electrozii din grafit sunt adesea folosite