Electroliților și proprietățile lor - Chimie
Mai mult: electroliți puternici. activitatea ion
Soluțiile apoase de săruri, acizi și baze posedă o anumită caracteristică - acestea conduc curentul electric. Sărurile Astfel anhidre solide și baze, precum și acizii anhidri nu conduc curent; aproape nu efectuează apă curentă, și curată. Evident, atunci când este dizolvat în apă astfel de substanțe sunt supuse unor schimbări profunde, care determină conductivitatea electrică a soluțiilor obținute.
De exemplu, atunci când curentul trece prin soluția de acid sulfuric, apa este descompus în părțile sale componente - hidrogen și oxigen au evoluat pe plăcile conectate respectiv la polii pozitivi și negativi baterie. Acest tip de soluții sunt chimic degradabile atunci când un curent trece prin ele, vom fi numit electroliți, iar procesul de descompunere a substanțelor electrocutarea - electroliza.
1. Determinarea electroliți
Se poate spune că electroliții - o substanță care conține o concentrație apreciabilă a ionilor care contribuie la trecerea unui curent electric (ion conductivitate). Electrolitii sunt numite și conductoare de al doilea tip.
Într-un sens restrâns - electroliti o substanță a cărei molecule în soluție, datorită disocierii electrolitice, disociază în ioni. Printre electroliti solizi sunt soluții distinși electrolitice și se topește de ioni. soluții de electroliți sunt adesea, de asemenea, denumite electroliti. În funcție de tipul de electroliți solvent sunt divizate în electroliții apoase și neapoase. Pentru o clasă specială de electroliți de greutate moleculară mare includ - polielectroliți.
În conformitate cu natura ionilor formați prin disocierea electrolitică a soluțiilor apoase, sarea este electroliți izolate (în care ionii de H + și OH -), acid (ioni H + predomină) și o bază (ionii în principal OH -). Dacă disocierea moleculară a numărului de cationi electroliți egal cu numărul de anioni, astfel electroliți sunt numite simetrice (1,1-valent, de exemplu, KCl, 2,2-valent, de exemplu, CaSO4. Etc.). Altfel numite electroliți asimetrice (electroliți 1,2-valent, de ex. H2 SO4. 3,1-valent, de exemplu, A1 (OH) 3, etc.). În funcție de capacitatea disocierea electrolitică a electroliților convențional împărțit în punctele forte și punctele slabe. Electroliții slabi sunt caracterizate în primul rând printr-o constantă și gradul de disociere și ionii de activitate puternici.
1.1 electroliți slabe. Constant și gradul de disociere
Molecule electroliții slabi doar parțial disociat în ioni, care sunt în echilibru dinamic cu molecule nedissotsiiruyuschimi. electroliții slabi includ mulți acizi organici și baze în solvenți apoși și neapoși. Gradul de disociere depinde de natura solventului, concentrația soluției, temperatura și alți factori ( <1). Один и тот же электролит при одинаковой концентрации, но в различных растворителях образует растворы с различной степенью диссоциации.
Soluțiile de electroliți slabi, se stabilește un echilibru între moleculele nedisociate și produsele disocierii lor - ioni. De exemplu, echilibrul stabilit în acid acetic apos
SNzSOON + H + CH3 COO -
A cărei constantă (constanta de disociere), asociată cu concentrațiile particulelor respective prin relația:
Gradul de disociere a electrolitului așa cum este numită fracție de molecule in curs de disociere, t. E. Raportul dintre numărul de molecule din soluție putrezite ionilor de electrolit la numărul total de molecule în soluție.
Dacă MX electrolit Disociindu pe ionii M + și X, precum și un grad constant de disociere sunt legate (legea de diluție)
unde C - concentrația molară a electrolit, moli / litru.
În cazul în care gradul de disociere este semnificativ mai mică decât una, atunci putem lua calcul aproximativ care 1 - A1. Apoi, legea de expresie mai ușor de diluare:
Acestea din urmă Raportul indică faptul că soluția la diluare (m. E. Odată cu scăderea concentrației de electrolit C), gradul de disociere a creșterilor de electrolit.
Dacă gradul de disociere ei este, concentrația ionilor în soluție și X M + sunt aceleași și cuprind o soluție de electrolit MX:
Substituirea o valoare a relației de mai sus, găsim:
Pentru calcule legate de disocierea acizilor, adesea este convenabil să se utilizeze decât un K constantă, și așa-numitul indice de pK constantă de disociere care este dată de
Este evident că, odată cu creșterea K, adică odată cu creșterea puterii de acid, valoarea pK scade ..; De aceea, cea mai mare pKa, mai slab acid.
Atunci când se administrează într-o soluție de electrolit slab de ioni similari (m. E. Ion identic cu unul din ionii produși prin disocierea electrolit), echilibrul de disociere este perturbată și deplasată în direcția formării de molecule nedisociate, astfel încât gradul de disociere a electrolitului scade. Astfel, adăugarea unei soluții de acid acetic, sărurile acestora (de exemplu, acetat de sodiu) va crește concentrația ionilor CH3 COO - și, conform principiului Le Chatelier, echilibrul de disociere este deplasată spre stânga.
SNzSOON + H + CH3 COO -
În soluții de acizi polibazici precum și baze conținând mai multe grupări hidroxil, sunt stabilite echilibru în trepte, corespunzătoare etapelor succesive de disociere. Astfel, disocierea acidului fosforic are loc în trei etape, fiecare dintre acestea corespunzând la o anumită valoare a vitezei constante de disociere. Deoarece K1 >> K2 >> K3. trece apoi la cel mai mare grad de disociere a primei etape, în timp ce trecerea fiecărei etape succesive, gradul de disociere este în general redus dramatic.
Disocierea electrolitului duce la faptul că numărul total al particulelor de solut (molecule și ioni) crește în comparație cu o soluție de concentrație molară aceeași nonelectrolyte în soluție. Prin urmare, proprietățile care depind de numărul total de particule în soluție de solut (proprietăți coligative) - cum ar fi presiunea osmotică, care scad presiunea vaporilor, punctul de altitudine de fierbere, punctul depresionare congelare - apar în soluții electrolitice la un grad mai mare decât în concentrație egală soluții de non-electroliți. În cazul în care, ca rezultat al disocierii numărului total de particule în soluția de electrolit este crescut de i ori în comparație cu numărul de molecule sale, trebuie luate în considerare la calcularea presiunii osmotice și alte proprietăți coligative. Formula de calcul a reducerii presiunii # 8710; p vapori de solvent devine în acest caz, după cum urmează:
p0 - presiunea vaporilor de peste solvent pur;
n2 - numărul de moli de solut;
n1 - numărul de moli de solvent;
i - factor de Van't Hoff sau coeficientul van't Hoff.
În mod similar scăderea temperaturii de cristalizare # 8710; tkrist și creșterea temperaturii de fierbere # 8710; este dată de soluția de electrolit B.P.
unde m - concentrația molal a electrolitului și K și E - constantă, respectiv cryoscopic și solvent ebullioskopicheskaya constantă.
În cele din urmă, pentru a calcula presiunea osmotică (P, kPa) soluție de electrolit cu ajutorul formulei
unde C - concentrația molară a electrolitului, moli / litru; R - constanta de gaz; (8.31 J mol -1 K -1..) T - temperatura absolută, K.
Este ușor de observat că factorul Van't Hoff i poate fi calculată ca raport # 8710; p. # 8710; tkrist. # 8710; punctul de fierbere. P găsit de experiență la aceeași valoare calculată excluzând disociație electrolitică (# 8710; rvych. # 8710; tkrist.vych, # 8710; tkip.vych, Rvych):
Coeficientul i izotonic asociat cu gradul de disociere a electrolitului și raportul
unde k - numărul de ioni în care molecula este disocierea electrolit (KCl pentru k = 2, pentru BaCI2 și Na2 SO4 k = 3, etc ...).
Astfel, din valorile experimentale gasite # 8710; p # 8710; .. Etc. valoare tkrist i, putem calcula gradul de disociere a electrolitului în soluție. Trebuie avut în vedere faptul că, în cazul electroliți puternice găsit în acest fel, valoarea și exprimă numai grad „aparent“ de disociere, la fel ca în soluții de electroliți puternici disociate complet. Diferența observată între gradul aparent de disociere a unităților conectate cu interacțiunile ion-ion în soluție.
Mai mult: electroliți puternici. activitatea ion
Informații despre activitatea „electroliți și proprietățile lor“
Categorie: Chimie
Numărul de caractere, inclusiv spații: 73378
Număr de mese: 4
Număr poze: 1

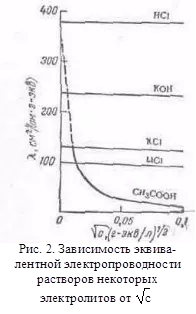


cu alți solvenți, considerăm că rennye modele sunt stocate, dar există abateri de la ele, de exemplu, pe curbe # 955; c este adesea observată cel puțin (o conductivitate electrică anormală). 2. Mobilitatea ionilor asociază electrolit conductivitatea la o viteză de mișcare TION ionilor săi într-un câmp electric. Pentru a calcula Elektroprom-conductivitate suficient pentru a contoriza numărul de ioni.

cu recuperare de oxigen - privarea de oxigen. Odată cu introducerea conceptului reacțiilor redox reprezentări de chimie electronice au fost extinse la o reacție în care oxigenul nu participă. In anorganica reacție chimie redox (IAD) poate fi formal considerată ca deplasarea electronilor dintr-un atom de reactant (agent de reducere) la un alt atom (.


studiul sintezei de noi materiale și procese de transport ionic în ele. În formă pură, astfel de modele pot fi identificate mai clar în studiul de cristal unic electrolit solid. În același timp, utilizarea electroliti solizi ca medii de lucru elementele funcționale trebuie să fie luate în considerare faptul că materialele au nevoie de un anumit tip și formă, cum ar fi o ceramică densă.
17-25 kg / t de alaun TION care
10-15 kg / m mai mare decât rezultatele pentru alumina dog-chanogo. Alumina utilizată pentru producerea aluminiului, să conțină cantitatea minimă de compuși de fier, dioxid de siliciu, metale grele, cu un potențial de evacuare inferior la catod decât aluminiul, deoarece ele sunt ușor reduse și tranzițiile DYT la catod de aluminiu. Indezirabilă ca prezența în.