Descompunerea termică a alcan, cracare
La o temperatură de 500 - 700 ° C se descompune pentru a forma cu greutate moleculară mai mică alcanii uglevodorov conținând saturate
și compuși nesaturați fătare. In acest frânte C-C-legături, și nu C-H-comunicare, deoarece cele mai recente decalaj de energie este mult mai mare. Homolysis legătură covalentă (reacția 1) conduce la formarea a doi radicali liberi care pot reacționa mai departe în mod diferit. De exemplu, radicalul poate detașeze un atom de hidrogen din molecula unui alcan pentru a forma un alean de dimensiuni mai mici și un nou radical (reacția 2). Inelul nou format poate fi împărțită în mai mici și radicalul alchena (reacția 3).
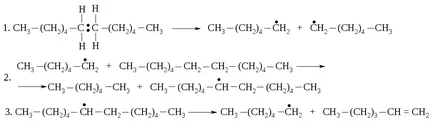
Ca urmare a unor astfel de reacții, molecule mari sunt transformate într-un amestec de alcani și alchene cu greutate moleculară mai mică.
1.6.16. alcani reacție ionici
Reacțiile cele mai tipice sunt substituție radical alean, dar în anumite condiții, reacția poate fi efectuată cu reactivi electrofili: proton H +. carbocationului CH3 +, și altele. NO2 nitroniu ion +.
Alcani reacționează cu superacid protonice, dintre care cel mai frecvent utilizat acidul fluorsulfonic FSO2 OH în amestec cu un acid Lewis SbF5 în SO2 lichid sau SO2 CLF.
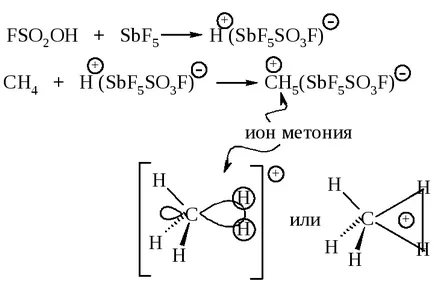
alchilare electrofilă este realizată prin reacția alcanii conținând compuși carbocationilor.
1.7. Metode de sinteză a alcanilor
Alcanii pot fi preparate în cantități practic nelimitate de petrol și gaze naturale. Cu toate acestea, izolarea hidrocarburilor individuale cu o creștere a numărului lor de atomi de carbon este dificilă, deoarece crește dramatic numărul de compuși izomerici și scad simultan diferențele în proprietățile lor fizice. Prin urmare, metodele de sinteză utilizate pentru obținerea hidrocarburilor individuale.
1.7.1. Hidrogenarea alchenelor și a alchinelor
hidrocarburi nesaturate (alchene, alchine, hidrocarburi cu mai multe legături multiple) pot fi convertite la alcani prin hidrogenare catalitică. Deoarece catalizatorul utilizat fin divizat de platină, paladiu sau nichel. Astfel de catalizatori sunt activate de către ambii hidrogen și alchena.
1.7.2. reacția Wurtz
În reacția halogenclorură primare cu alcanii sodiu metalic sunt formate cu de două ori numărul de atomi de carbon. Această reacție este adecvată în special pentru producerea de alcani superioare structură simetrică.
halogenclorură reactivitatea scade în ordinea: R-I> R-Br> R-CI.
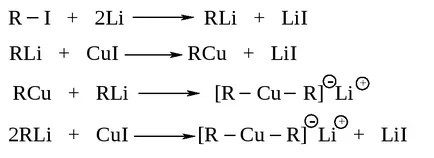
Structura alcani R-R „pot fi obținute utilizând o reacție Wurtz multiple modificat: Interacțiunea LiR2 Cu dialkilkuprata de litiu cu o halogenură de alchil R“ I. Se obțin Cele mai mari producții când gruparea alchil dialkilkuprata primar sau secundar, și gruparea alchil halogenură - primar.
Dialkilkupraty obținut proces în două etape, reacțiile sunt efectuate în eter dietilic absolut.
1.7.3. Hidrogenarea haloalcani
La hidrogenarea catalitică a halogenclorură în prezență de paladiu format alcani.
Pentru recuperarea halogenclorură poate fi utilizat ca zinc în acid clorhidric și sodiu în alcool. Iodalkany pot fi recuperate prin încălzire într-un tub sigilat cu HI.
1.7.4. Decarboxilarea acizilor carboxilici
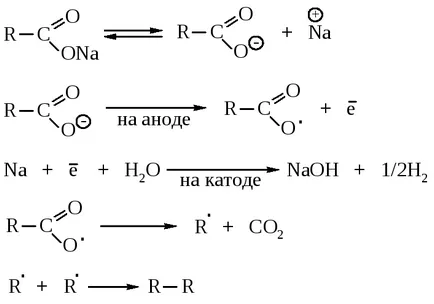
Atunci când sunt încălzite, săruri ale acizilor carboxilici și hidroxizi ai metalelor alcaline sau alcalino cu clivaj sodiu sau bariu se produce CO2 și alcani.
În mod unic, această reacție are loc numai pentru acetatul de sodiu, produsele secundare sunt formate în cazul altor săruri.
In electroliza sărurilor de sodiu și potasiu ale acizilor carboxilici se formează hidrocarburi structura simetrice.
În prima etapă oxidarea anodică a anionii acizilor la radicali RSOO . care este CO2 scindat. și apoi dimerize. La hidrogenul catodic se formează și un hidroxid de metal alcalin.
1.7.6. Metoda Fischer-Tropsch
Prin hidrogenarea catalitică a veniturilor de monoxid de carbon în prezența unui catalizator care conține cobalt sau fier, pentru a forma un amestec de alcani cu greutate moleculară mică.
2. stereoizomeri. enantiomer
2.1. Enantiomerii. Chirality. Condiții de chiralitate

În plus față de izomeri structurali există între izomeri configuraționali alcani. Acest lucru poate fi reprezentat de exemplu de 3-metil-hexan.
Atomul de carbon desemnat C *, este conectat la patru grupe diferite. Această hidrocarbură în aceeași ordine de atomi care leagă grupările alchil pot fi aranjate diferit în spațiul din jurul atomului de carbon C *. Există mai multe moduri imaginea izomerilor spațiale pe planul (fig. 2.1, 2.2).
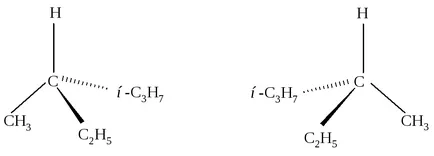
Fig. 2.1. imagine tridimensională cu ajutorul „pene“
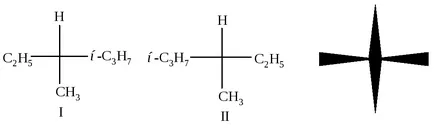
Fig. 2.2. formulă de proiecție Fischer
Figura 2.2 în centrul este atomul de carbon C *, linia orizontală indică relația dintre C * carbon și grupe proeminente planul frontal al figurii, și verticală - între un atom de C și * grupuri situate în spatele planului desenului. proiecție Fischer poate fi rotit doar în planul desenului și doar aproximativ 180. dar nu la 90 ° sau 270 °. Aceste formule sunt prezentate doi compuși diferiți. Acestea diferă unul de altul, în același mod ca și un obiect și imaginea sa în oglindă sau mâna stângă și dreaptă. Din stânga și din dreapta - cele două sunt foarte asemănătoare între ele pe această temă, dar nu pot combina (nu pune pe mănușa stânga la dreapta), apoi - este de două obiecte diferite.
Două conexiuni: un obiect și imaginea sa în oglindă (I și II), sunt incompatibile unele cu altele, se numesc enantiomeri (de la grecescul „enantio“ - opusul).
Proprietatea compușilor exista ca enantiomeri este numit chiralitate (din limba greacă „Hiroshi“ - mână), și compusul însuși - chiral.
Molecula are chiralitate, în cazul în care nu are plan de simetrie. Există o serie de elemente structurale, ceea ce poate face ca molecula nu este identică cu imaginea sa în oglindă. Cel mai important dintre acestea este un atom de carbon chiral.
Atomul chiral sau centrul chiral - atomul de carbon este legat la patru grupe diferite, și denotă mi-C *.
molecula 2-metilhexan are nici un plan de simetrie și, prin urmare, pot exista ca enantiomeri (vezi. fig. 2.1).
O moleculă în care un atom de carbon are două sau mai multe identice grupuri are un plan de simetrie și, prin urmare, nu are nici o chiralitate ca moleculă și imaginea sa în oglindă identice. Astfel de molecule sunt numite achiral.
De exemplu, izopentan pot exista ca enantiomeri și nu are nici o chiralitate (Fig. 2.3).

Fig. 2.3. Achiral molecula izopentan
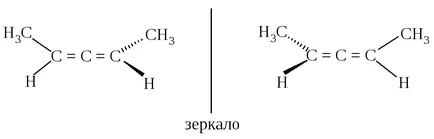
Un alt element al structurii, ceea ce face ca molecula poate exista ca enantiomeri - alene chirale. Molecula de alena nesubstituit (propadienă) achiral.
Moleculei alena două planuri în care se afla doua grupare metilen terminală CH2. perpendicular unul pe altul.
Din cauza acestui tip de alene substituite XYC = C = CXY nu au un plan de simetrie și pot exista ca enantiomeri.
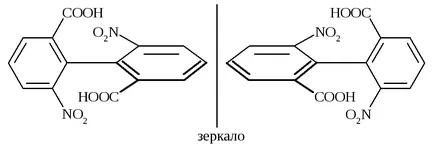
Un alt exemplu poate fi derivați de bifenil, în care substituenții la poziția orto pozițiile sunt suficient de mari pentru rotația liberă dovedit imposibilă. Ele pot exista ca enantiomeri, în ciuda absenței atomilor chirali. Acest tip de izomerie numit atropizomeri.
compuși nu întotdeauna neavând plan de simetrie, prezintă chiralitate și pot fi separate în enantiomeri. De exemplu, un metiletilamino azot CH3 (C2 H5) NH are patru substituenți diferiți: H, CH3. C2 H5 și perechea de electroni singulară, care se afla la nodurile tetraedru.
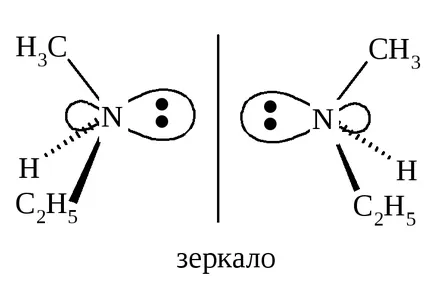
Aparent, un astfel de compus ar trebui să existe ca enantiomeri și prezintă activitate optică. Cu toate acestea, incapacitatea de a scinda amina enantiomerilor instabilitatea configurațională metiletilamină datorată, un enantiomer este transformat rapid în altul.
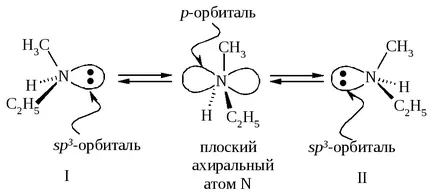
Inversiune piramidă metiletilaminei I → II și II → I este realizată printr-un atom de azot plat achiral. Prin urmare, metiletilaminei constă dintr-un amestec echimolecular de enantiomeri, prin urmare, nu sunt separați în enantiomeri individuali și nu prezintă activitate optică.
Dacă amina din cauza perechii unshared de electroni formează o legătură care împiedică molecula „dovedesc“, particula devine configurationally stabilă.
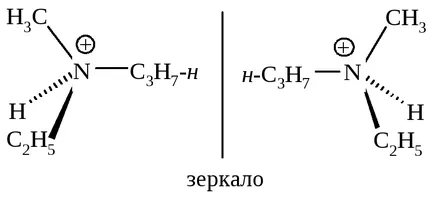
Cation metietilpropilammoniya exista ca enantiomeri.
Prin urmare, compușii care nu au un plan de simetrie pot exista ca enantiomeri și prezintă activitate optică numai în cazul în care acestea sunt configurationally stabile.
Enantiomerii prezintă aceleași proprietăți fizice, cu excepția unuia. De exemplu, molecula 2 -bromobutan exista ca doi enantiomeri. Ei au același punct de fierbere, punctul de topire, densitate, solubilitate, indici de refracție. Unul din Distinge celălalt enantiomer poate fi semnul de rotație al luminii plan polarizate. Enantiomer rotește planul luminii polarizate în același unghi, dar în direcții opuse - una în sens orar, celălalt - la același unghi, dar invers acelor de ceasornic.
Enantiomerii au proprietăți chimice identice, viteza interacțiunii lor cu reactivi lipsesc chiralitatea este aceeași. In cazul reacției cu un reactiv optic activ sunt diferite viteze de reacție ale enantiomerilor. Uneori, ele sunt atât de diferite încât reacția agentului cu unul dintre enantiomeri nu se scurge deloc.