de lucru 2
6. Este posibilă interacțiunea dintre oxizii: Li 2 O și SO 3; Na 2 O și BeO; Al 2 O 3 și K 2 O; BaO și MgO; N 2 O 5 și ZnO? Da un răspuns motivat și să aducă ecuația reacțiilor corespunzătoare.
7. Ce proprietăți hidroxizi NaOH, Al (OH) 3. Ni (OH) 2 pot fi utilizate pentru separarea lor din amestecul solid?
Obiectiv - asimilare concepte echivalente molare greutate echivalentă metode de calcul molar echivalenți de masă substanțe; Determinarea experimentală a metalului necunoscut metoda volumetrică echivalentă.
estimări cantitative chimie bazate pe legea conservării masei (Lomonosov, 1756, Lavoisier, 1785): masa egală cu masa reactanților produșilor de reacție. Pentru a determina cantitățile de produse de reacție formate atunci când o cantitate cunoscută de reactivi necesare pentru a crea o reacție completă cu coeficienții de ecuații.
chimiștii germani Wenzel și Richter formulat echivalente de drept (1793): substanțele reacționează și formă în cantități echivalente, ceea ce permite calculul fără a face o ecuație completă a reacției.
Per unitate echivalent adoptat 1 mol de atomi de hidrogen, din care masa molară este egală cu 1 g / mol (mai precis, 1.00794 g / mol). Echivalențe alte substanțe definite cantitatea de substanță care este în reacții chimice este echivalentă (sau se leagă înlocuit) 1 mol de atomi de hidrogen sau un electron în reacțiile de oxidare-reducere.
Numărul care indică procentajul de moli de substanță echivalentă cu un atom în reacția hidrogenului sau a unui singur electron este numit un factor de echivalență f.
Factor de echivalență echivalență număr Z inverse care este numeric egală cu valoarea absolută a gradului de oxidare
ion sau numărul de electroni transferați reducătorului sau oxidant din oxidant adoptat reducătorului: f = 1 / Z.
Masa moleculară M eq echivalentă Z ori mai mici decât masele molare corespunzătoare M substanțe care participă la reacție:
substanță echivalentă nu este constantă, se calculează pentru fiecare reacție în care este implicată această substanță.
Exemple de calcule.
1. Determinarea maselor molare și echivalența echivalenților substanțelor implicate în reacții de schimb:
a) pentru numărul de acid de echivalență determinată de cantitatea de ioni de hidrogen sunt înlocuiți cu ioni metalici, adică. e.
+ NaOH → NaH2PC 4
+ H 2 O; Z k = 1; M = ekv.k
H 3 PO 4 + 2NaOH → Na 2 HPO 4
+ 2H 2 O; Z k = 2; M = ekv.k
+ 3NaOH → Na 3 PO 4 + 3H 2 O; Z k = 3; M = ekv.k
b) pentru numărul de bază determinată de cantitatea echivalenta de ioni de hidroxid care sunt substituiți cu anioni de acizi, și anume bază aciditate ..:
+ HCl → Al (OH) 2 Cl + H 2 O; Z est = 1; M = ekv.osn
Al (OH) 3 + 2HCl → Al (OH) Cl 2 + 2H 2 O; Z = OCH2; Ekv.osn M = M ≈ 39 g / mol;
Al (OH) 3 + 3HCI → Al (OH) 3 + 3H 2 O; Z = OCH3; Ekv.osn M = M ≈ 26 g / mol;
c) Numărul de echivalență al produsului sare este determinată de gradul de oxidare a cationului (sau modulo anion) n numărul ionilor m, Z = nm:
NaCl: Z = 1 · 1 = 1; M = M eq ≈ 58,5 g / mol
Na 2 SO 4. Z = 1 × 2 = 2; M eq = 1 / 2M ≈ 71,0 g / mol
Al 2 (SO 4) 3. Z = 3 x 2 = 6; Ec = 1 M / 6M ≈ 192 g / mol
2. Determinarea numărului de echivalenŃă și masa molara echivalenți de oxidant și reducătorul în reacții redox.
Numărul de echivalență al oxidantului și reducătorul în reacția de oxidare-reducere, determinată de numărul de electroni acceptat sau turnate.
2KMnO 4 + 5K 2 SO 3 + 3H 2 SO 4 → 2MnSO 4 + 6K 2 SO 4 + H 2 O
SO 3 2- - 2e + H 2 O → SO 2 Aprilie - + 2H + Z = 2;
Experimental, echivalentul unei substanțe simplu poate fi determinată de numărul de hidrogen substituibil sau un atom de oxigen atașat, sau un alt element, al cărui echivalent este cunoscut. Echivalentă poate fi determinată prin mijloace electrochimice pe baza legii lui Faraday, potrivit căreia trecerea de încărcare 96484 Cl prin soluția de electrolit la electrozi devine o singură substanță echivalentă.
În această lucrare, o metodă de determinare a echivalentului de metal activ, bazat pe măsurarea volumului de hidrogen eliberat în timpul dizolvării metalului în acid clorhidric:
Me + → MeCh n N de HCI + n / 2H 2
Conform echivalenții legii, un echivalent al unui metal dislocă un echivalent de hidrogen, cu un echivalent molar de masă 1 g / mol.
Folosind legea lui Avogadro, putem defini un volum care ia una echivalenți molari de hidrogen în anumite condiții fizice. În condiții fizice normale (STP,
p = 1,013 × 10 5 Pa, și p = 760 mmHg. Art. T = 273 K) 1 mol de hidrogen având o greutate de 2 g / mol, ocupă un volum de V = 22,4 litri, apoi 1 echivalenți molari de hidrogen având o greutate de 1 g / mol, ar trebui să ocupe volumul V eq H 2 = 11,2 litri .
În acest fel, este posibil să se calculeze volumul ocupat de un echivalent de orice gaz. De exemplu, pentru o cantitate echivalentă de O 2 egal cu V eq H 2 = 5,6 litri (STP), echivalenți de masă molară
că oxigenul este de 8 g / mol, și este de 1/4 din volumul molar; la hidrogen clorură de 1 mol echivalenți ocupă un volum V eq HCl = 22,4 litri (STP), ca greutate echivalentă molar egală cu masa molară (Z = 1).
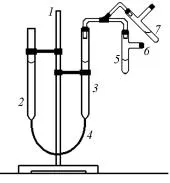
greutate echivalentă molar de metal a fost determinată printr-un instrument numit eudiometru (Fig. 2.1). Dispozitivul 1 cuprinde un trepied pe care sunt fixate biuretă 2 și 3 biureta furtun 4. conectat având o secțiune transversală de 1 cm2 și calibrat cu o precizie de 0,1 cm, punctul zero este în partea superioară
Aceasta parte a biuretă.
Pentru biureta 3 este conectat cu tubul de evacuare 5 țeavă 6. biuretă umplută cu apă, tubul 5 - acid clorhidric concentrat. Tubul de evacuare a fost plasat proba de metal cu masă cunoscută. După încărcarea metalului, instrumentul este verificat pentru scurgeri de informații, ridicarea și coborârea byu-
Fig. 2.1. Eudiometru Roethke 2 relative biurete 3, în care nivelul apei în acest caz va varia, dar nu tind să se egalizeze cu nivelul
Dispozitiv de biureta 2. După verificarea etanșeității în nivelurile de apă egaliza poziție în ambele biurete și marchează poziția nivelului din biuretă 3 de-a lungul meniscului inferioare, înregistrând valoarea scalei etalonare la 1 oră 0,1 cm.
Apoi îndepărtați cu atenție metalic în acid, traducerea tub 5 din poziția 6 în poziția 7. În procesul de dizolvare a biureta metalic 2 este coborât, astfel încât nivelul apei din biureta nu este prea diferit. La finalul procesului de dizolvare de metal în nivelurile de acid poziție aliniată cu precizie în ambele biurete și a înregistra nivel poziție nouă h 2 în biuretă 3.
Volumul de hidrogen evoluat în reacție, V este diferența de nivel V = h 2 - h 1. măsurată în centimetri cubi (mililitri) în condițiile atmosferice (p, T) ale experimentului.
În conformitate cu legea E Meth echivalenți de metal echivalent. având o masă M molar eq. dislocă echivalent apă
N. E un fel care, în condiții normale, ocupă un volum V = eq = 11 și 200 cm3 utilizat în m experiment masa de metal dislocă volumul de hidrogen V 0. redus la condiții normale:
Calcularea masei molare a echivalentelor metalici ecuației (2.3) poate fi determinată prin selectarea valorilor metalice ale masei M său molar = M ekv.eksp Z, indicându-se, de exemplu, trei valori consecutive Z, egal cu 1, 2 și 3.
Sistemul periodic al elementelor DI Mendeleev selectați din metal care prezintă o valență Z corespunzătoare, pentru care diferența calculată masele molare de masă mai mică de 1 ... 2 g / mol. Apoi, ne asteptam pentru a experimenta o eroare relativă din ecuația
M = M ekv.tabl - M ekv.eksp 100%
ekv.eksp unde M - metale masa molară echivalentă, calculată din datele experimentale conform ecuației (2.5); M ekv.tabl - masa molară teoretic de echivalent metalic, calculat conform ecuației
M = M Tabelul ekv.tabl / Z.
Rezultatele obținute în Tabelul face. 2.2.
Întrebări pentru a pregăti un laborator de apărare
1. Vă rugăm să indicați compușii molar greutate echivalentă este jumătate din masa lui molară: CO 2. Ca (OH) 2. Na 2 HPO 4. KHS, K 2 Cr 2 O 7. K 2 CrO 4.
2. Se calculează greutatea molară echivalentă de următorii agenți reducători: a) clorură de staniu (II), oxidarea la clorură de staniu (IV); b) fosfor elementar este oxidat la H 3 PO 4; c) peroxidul de hidrogen este oxidat la oxigen molecular.
3. în reacția H 3 PO 4 acid fosforic cu sare de acid hidroxid de potasiu format - fosfat diacid de potasiu. Scrieți reacția și se determină numărul de echivalență a echivalentului masa molară alcaline, acizi și săruri în reacție.
4. În industrie multe metale obținute prin acțiunea hidrogenului asupra compușilor lor. Calculați masa metalului și a echivalentului său oxid, dacă recuperarea 0,27 greutate apă formată din metal greutate oxid de 1,2 g hidrogen Call acest metal dacă valență egal cu doi.
5. Calculați masa molară a acidului sulfuric echivalent cu următoarele reacții:
a) Zn + H 2 SO 4 (dil) → ZnSO 4 + H 2
b) 2HBr + H 2 SO 4 (conc) → Br 2 + SO 2 + 2H 2 O în) 8HI + H 2 SO 4 (conc) → 4I 2 + H 2 S + 4H 2 O
Pentru a continua descărcarea aveți nevoie pentru a asambla o imagine: