Cum pentru a determina numărul de electroni dintr-un atom, fac totul singur
Un atom constă dintr-un nucleu foarte dens, înconjurat de un electron „nor“. Kernel rău puțin în comparație cu dimensiunile exterioare ale norului, și este format din protoni și neutroni. Atom în stare obișnuită este neutră, iar electronii transporta o sarcină negativă. Dar, de asemenea, un atom poate trage electronii străini, sau să dea propria ta. În acest caz, acesta va fi deja încărcat negativ sau pozitiv încărcat de ioni. Cum de a determina cât de mulți electroni conținute în atomul?

instrucție
1. Înainte de fiecare, va veni în ajutorul tabelului periodic. Privind la ea, veți vedea că toate elementul chimic are nu numai pupa un anumit loc, dar, de asemenea, un număr personal de serie. Spun hidrogen, este unitatea, carbonul - 6, pentru aur - 79 și așa mai departe.
2. Acest număr de secvență specifică numărul de protoni din nucleu, adică încărcătura corectă a nucleului atomic. Din faptul că un atom într-o stare obișnuită de încărcare neutră, pozitivă trebuie să fie echilibrată de o sarcină negativă. Prin urmare, într-un atom de hidrogen - un electron carbon - șase electroni. pentru aur - șaptezeci și nouă de electroni.
3. Dar cum pentru a determina numărul de electroni dintr-un atom. dacă atomul este, la rândul său, este o parte a unor molecule mai mari sunt dificil? De exemplu, ca numărul de electroni din atomii de sodiu și clor, când acestea formează fiecare moleculă revocați sare comună faimos?
4. Nu este nimic dificil. Începe cu faptul că scrie formula acestei substanțe, aceasta va avea o altă vedere: NaCI. Din formula veți vedea că molecula constă dintr-o sare a 2 elemente, și anume, un gaz alcalin sodiu metalic halogen și clor. Dar nu este aproape neutru de sodiu și atomii de clor și ionii lor. Clor, formând o legătură ionică cu sodiu, astfel „tras“ de la sine unul dintre electronii. și sodiu, respectiv, acesta „a dat“.
5. Din nou, uita-te la tabelul periodic. Vei vedea că sodiul are un număr de serie 11, clor - 17. În consecință, acum avem ionul de sodiu este de 10 electroni. în ionul clorură - 18.
6. Acționând pe același algoritm care a permis ușor să se determine numărul de electroni în toate element chimic, fie sub forma atomului neutru sau ion.
element chimic Atom este format dintr-un miez nuclear și electroni. Compozitia miezului nuclear include două tipuri de particule - protoni și neutroni. Aproximativ fiecare masă atomică concentrat în miez, deoarece protonii și neutronii sunt mult mai grele decât electroni.

- număr atomic, izotopi
instrucție
1. Spre deosebire de protoni, neutroni nu au nici o sarcină electrică, adică taxa lor electrică este zero. În consecință, cunoscând numărul de elemente de bază, este imposibil să spunem cu certitudine cât de mulți neutroni conținute în nucleul său. De exemplu, în atomii de carbon nucleu conține invariabil 6 protoni, protoni deși poate fi 6 și 7. Variații elementelor chimice nuclee cu un număr diferit de neutroni in nucleu se numesc izotopi ai acelui element. Izotopi poate fi atât naturale, cât și nefiresc obținute.
2. nucleu nuclear desemnat simbolul alfabetic al unui element chimic din tabelul periodic. La dreapta simbolului în partea de sus și în partea de jos există două numere. Numărul de sus A - este numărul de masă al atomului, A = Z + N, unde Z - taxa nucleară (numărul de protoni) și N - chisloneytronov. Numărul de jos - este Z - taxa a nucleului. Această înregistrare oferă informații cu privire la numărul de neutroni din nucleu. Aparent, este egală cu N = A-Z.
3. Diferite izotopi ai unui element chimic O serie de modificări, care se reflectă în înregistrarea acestui izotop. Anumiți izotopi au numele lor reale. De exemplu, un nucleu de hidrogen obișnuit nu are un neutron și un proton. Izotopilor de hidrogen deuteriu este un neutron (A = 2) și izotop tritiu - doi neutroni (A = 3).
4. Numărul Relatedness de neutroni înregistrate de numărul de protoni la N-Z diagrama miezuri nucleare. Stabilitatea nucleelor depinde de raportul dintre numărul de neutroni și numărul de protoni. Miezuri nuclides lumină deosebit de stabilă când N / Z = 1, adică cu un număr egal de neutroni și protoni. Odată cu creșterea numărului de schimburi de regiune de stabilitate în masă la valorile N / Z> 1, atingând o valoare de N / Z
1.5 pentru nuclee deosebit de grele.
Atom constă dintr-un nucleu și electronii din jurul său. care se rotesc în jurul orbitalii electronice nucleare pentru a forma straturi (niveluri de energie). Numărul de particule încărcate negativ asupra nivelurilor externe și interne, determină proprietățile elementelor. Chisloelektronov. conținut în atomul, îi este permis să descopere, știind unele puncte-cheie.
- - hârtie;
- - mânerul;
- - Sistemul periodic lui Mendeleev.
instrucție
1. Pentru a determina numărul de electroni. Utilizați DI sistemului periodic Mendeleev. Elementele de masă sunt aranjate într-o anumită secvență, care este legată de structura lor nucleară îngustă. Știind că sarcina pozitivă a atomului întotdeauna egal cu numărul de ordine al unui element, puteți găsi cu ușurință numărul de particule negative. Ceaiul vestimo - un atom neutru împreună, și, prin urmare, numărul de electroni este egal cu numărul de protoni, și numărul elementului din tabel. De exemplu, secvența numărul de aluminiu este 13. Prin urmare, numărul de electroni va fi de 13 in sodiu - 11, în fier - 26, etc.
2. În cazul în care aveți nevoie pentru a găsi numărul de electroni în nivelurile de energie, se repetă prima regulă a statului Pavel și a lui Hund. Apoi distribui particulele negative prin niveluri și subnivele cu ajutorul aceluiași sistem periodic, sau mai degrabă perioade și grupurile sale. Deoarece numărul rând orizontal (perioada) indică numărul de straturi de putere și verticală (e) - numărul de electroni din categoria exterior.
3. Nu uitați că numărul de electroni externi este egal cu numărul de grup numai elementele care sunt în principalele subgrupe. În elemente de sub-grupuri ale numărului de particule incarcate negativ de pe nivelul de sus al energiei nu poate fi un imens 2. Say scandiu (Sc), situată în perioada 4, în grupa 3, subgrupul incidentală 2. In timp ce galiu (Ga), cel care se află în aceeași perioadă și același grup, dar în subgrupul principal , 3 electroni exteriori.
4. Atunci când numărarea a electronilor într-un atom, rețineți că ultima formă a moleculei. Atomii pot lua, pentru a da un particule încărcate negativ pentru a forma un cuplu universal. De exemplu, în molecula de hidrogen (H2) pereche universală de electroni. Un alt caz: în moleculă, fluorură de sodiu (NaF) o cantitate generală de electroni va fi egal cu 20. Cu toate acestea, în timpul reacției chimice a atomului de sodiu dă electron și este 10, și primește fluor - 10 se transformă, de asemenea.
sfat sănătos
Amintiți-vă că în nivelul de exterior al energiei poate fi doar 8 electroni. Și nu depinde de locația elementului din tabelul periodic.
Atom - este cel mai mic stabil (în majoritatea cazurilor) particulă de materie. Molecule de asemenea, numit mai mulți atomi legați împreună. Această moleculă este stocată în sine informația cu privire la toate proprietățile unei anumite substanțe.
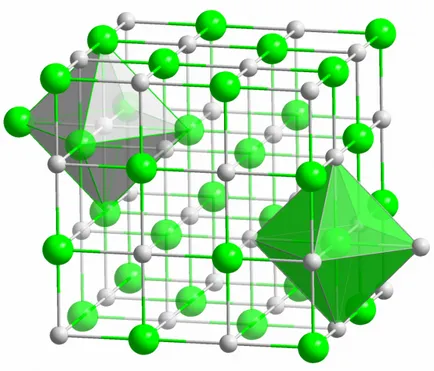
Atomii formează molecula prin intermediul diferitelor tipuri de comunicare. Acestea diferă în direcția și energia, cu ajutorul căruia a permis această relație, pentru a forma.
Modelul cuantică a legăturii covalente
Legătura covalentă este formată prin electroni de valență. Când se apropie de 2 atomi monitorizate nori de electroni care se suprapun. Electronii tuturor atomilor încep să se miște în zona aparținând altui atom. În spațiul din jurul lor, există un potențial negativ excesiv, unul care trage nuclee încărcate pozitiv. Acest lucru este valabil numai în condițiile în care electronii sunt rotiri antiparalela generale (regia în direcții diferite) conexiune .Kovalentnaya are o valoare destul de mare de energie din cauza pentru a acoperi un atom (aproximativ 5 eV). Acest lucru înseamnă că necesitatea de a 10 eV, astfel încât o moleculă de 2 atomi formează o legătură covalentă rupt. Atomii pot veni mai aproape unul de altul la aproximativ un anumit stat. Cu această convergență suprapunere de nori de electroni urmărită. Teza Pauli spune că în jurul valorii de același atom nu se poate roti doi electroni într-o stare identică. Huger urmarite se suprapun, cu atât atomii se resping reciproc.
legătură de hidrogen
Acesta este un caz special al unei legături covalente. Este format din doi atomi de hidrogen. Acesta este un exemplu de un element chimic în douăzeci secolului trecut, sa demonstrat mecanismul de formare a legăturii covalente. dyuzhe hidrogen primitiv în structura sa, care a permis oamenilor de știință să decidă cu privire la ecuația Schrodinger adevărată.
legătură ionică
Crystal fiecare vestimo sare formată prin legături ionice. Ea apare atunci când atomii care formează molecula, posedă o mare diferență în electronegativitate. electronegativ mai puțin (în cazul cristalului de sare este de sodiu) trimite toate clor și electroni de valență, devenind ion încărcat corespunzător. Clorul, la rândul său, devine un ion încărcat negativ. Acești ioni sunt legați în structura unei interacțiuni electrostatice, care se caracterizează prin forță destul de extinsă. De aceea, legătură ionică are cea mai mare concentrație (10 eV per atom, care este de două ori mai mult decât Huger energia unei legături covalente). În cristale ionice dezavantajele diferitelor tipuri dyuzhe rar monitorizate. interacțiune electrostatică ține ferm ionii pozitivi și negativi în anumite locații apar prevenind posturi vacante, dal ofinterno- și alte dezavantaje ale rețelei cristaline.
sfat sănătos
Protonii - l încărcat aprobator particule, neutroni nu poartă nici o taxă.
a se vedea, de asemenea,
- Cum de a calcula vârsta de pisica

- Cum de a lega o haină pentru fete

- Cum de a determina vârsta de broască țestoasă

- Cum de a găti ventriculele
