Cum grilaj metalic kiziyarsky Metalice Plant
corp solid, lichid, gazos: ce au în comun? Desigur, particulele din care acestea constau. Astfel, toate substanțele chimice sunt formate din particule minuscule care sunt link-uri interconectate: mai mult sau mai puțin puternice, în funcție de starea de agregare. Particulele formează un grilaj. Rețeaua cristalină a metalelor - este unul dintre tipurile de grilaje reprezentate în natură.
zăbrele compoziţie
Deci, chiar de la un curs școală de chimie și fizică, știm că absolut toate substanțele constau din particule mici, care sunt interconectate. Și aici este puterea de obligațiuni depinde în ce stare de agregare este organismul: solid, lichid sau gazos. Atunci când particulele au o orientare strict în spațiu, ele formează un corp solid. Toate solidele au contururi clare ale unei structuri clare a părților lor mici. În ceea ce privește amenzile, în ciuda locul său strict în spațiu, ei încă mai continuă să se miște. Viteza și amplitudinea acestei mișcări depinde de temperatură: dacă este mai mic decât zero, atunci rata scade și formează un corp rigid în raport cu temperaturi ridicate, într-un astfel de caz, se va forma corp gazos și lichid și particulele se vor deplasa mutat rapid și simplu.
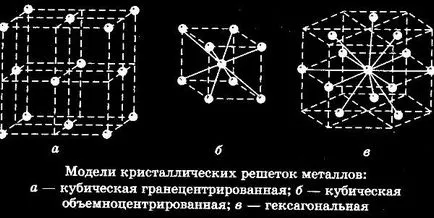
Să ne toate la fel cu privire la organizarea de solide. Când particulele (atomi, molecule sau ioni) cu localizare precis definită în spațiu, astfel se angajează rețeaua cristalină. Particulele pot fi amplasate fie în spațiul dintre noduri și nodurile direct. Molecular, atomic, metal si ion - aceste patru tipuri de matrice există în natură. Diferența dintre gratarele se reduce la particule care sunt la nodurile și legăturile care apar între ele.
zăbrele moleculare
Moleculară rețea cristalină este o moleculă, care sunt situate la nodurile. Astfel de particule sunt legate mai degrabă legături slabe - intermoleculară, care sunt, de asemenea, numite van der Waals. Cu toate acestea, moleculele sunt ele însele compuse din atomi. există o relație mult mai puternică și mai puternică între atomii, numit covalentă. Acest tip are o rețea cristalină în clor, dioxid de carbon, hidrogen și alte substanțe solide, care sunt în stare gazoasă la temperatura normală. Adică, o astfel de structură este adesea găsit în natură. Astfel, chiar și substanțele anorganice pot avea o astfel de structură: halogenuri rigide, gheață, sulf și altele. Datorită temperaturii scăzute de topire a corpului, cu o structură a structurii aprinse și topite foarte repede.
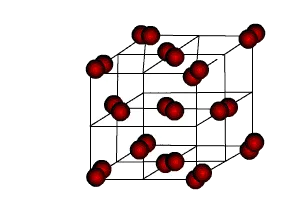
În ceea ce privește structura, care este rețeaua cristalină de metal, aceste tipuri de particule să circule liber doar în corpul cristalului, care este situat într-o unitate bine definită. Cu toate acestea, astfel de particule sunt capabile să se deplaseze liber prin rețeaua cristalină. Deoarece particulele din care cuprinde un grilaj metalic încărcat diferit, ele sunt atrași unul de celălalt și formează o structură metalică.
gaz electronic Due, care este format din electroni liberi se deplasează, metalul poate avea proprietăți de conductivitate electrică și termică ridicată. După ce zăbrele caseta într-un câmp electric, electronii sunt trimise imediat la partea pozitivă a particulelor. Din cauza unor astfel de mișcări generate curent. Acest tip de grilaj este adesea metale elementare și este adaptată pentru conectarea diferitelor metale.
Dar, în ciuda acestui fapt nu se poate spune cu exactitate că proprietățile tuturor metalelor sunt aceleași, ele sunt, dimpotrivă, radical diferite unele de altele. Deoarece interacțiunea dintre electroni și ioni produc tipul de metal. De asemenea, rețeaua cristalină formată prin electrodul liber care zboară în zăbrele. Datorită metalelor cu zăbrele au o temperatură de topire ridicată (mai mare decât substanța organică).
articole asemanatoare:
Nu sunt materiale similare.