Cum de a găsi numărul de protoni și neutroni fac totul singur
Protonii și neutronii sunt conținute în miezul nuclear, sunt numite nucleoni. Din faptul că masa reală a fiecărui atom este concentrată în nucleul său, numărul de masă al atomului este numărul de nucleoni. Cu sprijinul tabelului periodic al elementelor chimice este permisă pentru a detecta numărul de protoni și neutroni. De asemenea, a permis să utilizeze alte metodologii.
- - tabelul periodic al elementelor chimice;
- - taxa de protoni;
- - indicații ale elementelor chimice.
instrucție
1. Fiecare atom corespunde elementului de substanță din tabelul periodic. Detect un element pentru un număr de atomi în nucleul de protoni și neutroni, care ar trebui să detecteze. Se determină masa nucleară a elementului. Acesta este situat în partea de jos a celulei, care este situat un element chimic. În cazul în care numărul de masă este reprezentat de o valoare fracționată, se rotunji la cel mai apropiat întreg. Acest număr este egal cu numărul de nucleoni din atom. De exemplu, magneziul definesc masa nucleară. Detect elementul activ din tabelul periodic, acesta are o denumire Mg. Numărul său de masă este de 24.305. Runda l la întreg și obține 24. Aceasta înseamnă că numărul de protoni și neutroni (nucleoni) în nucleul unui atom al elementului este de 24.
2. Se determină numărul de protoni din nucleul unui atom. Pentru că detecta în tabelul periodic al elementelor chimice. În partea de sus a elementului observat prin numărul său de serie într-un rând în celulă de tabel. Acesta este numărul de protoni din nucleul unui atom al unui element. De exemplu, numărul de ordine de magneziu (Mg) este egal cu 12. Aceasta înseamnă că cele 12 protoni conținute în nucleul său.
3. Din când în când să se limiteze la taxa nucleară în coulombi, apoi, în scopul de a detecta numărul de protoni, împărțiți numărul de încărcare a unui singur proton, cel care este egală cu 1,6022 • 10 ^ -19 Coulomb. De exemplu, în cazul în care celebra taxa pe nucleul de 35,2 • 10 ^ -19 Coulomb, apoi împărțirea la 1,6022 • 10 ^ -19 obține numărul. aproximativ egală cu 22. Acest lucru înseamnă că, în nucleul atomului 2 este protonul.
4. Ulterior, determinarea numărului de protoni a detecta numărul de neutroni din nucleu. Pentru a face aceasta masa relativă a nucleului nuclear detectate prin intermediul tabelului periodic al elementelor chimice, se scade numărul de protoni conținute în nucleu. Din faptul că, în plus față de neutroni alte particule grele din nucleul unui atom nu este conținut, acesta va fi numărul de neutroni. De exemplu, dacă este necesar, pentru a detecta numărul de protoni și neutroni din nucleul de fosfor (P), detecta în tabelul periodic, se determină numărul de masă și numărul de serie al elementului. Numărul de masă de fosfor este egal cu 30.97376? 31, iar numărul de serie 15. Aceasta înseamnă că nucleul unui atom al elementului chimic conține 15 protoni și neutroni 16 = 31-15.
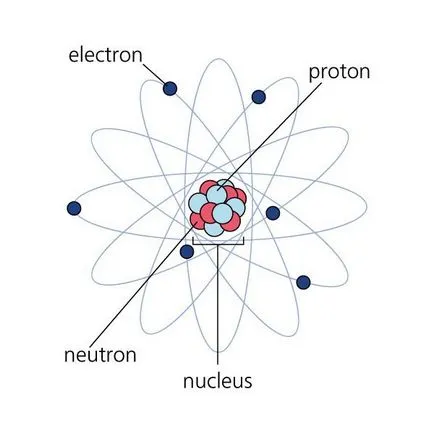
element chimic Atom este format dintr-un miez nuclear și electroni. Compozitia miezului nuclear include două tipuri de particule - protoni și neutroni. Aproximativ o masă atomică este concentrată în miez, deoarece protonii și neutronii sunt mult mai grele decât electroni.

- număr atomic, izotopi
instrucție
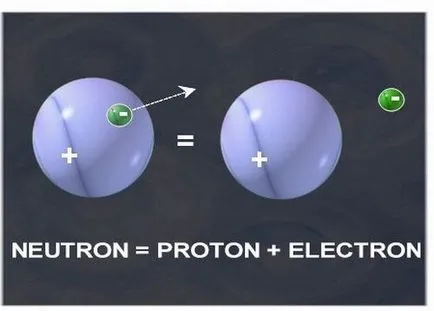
1. Spre deosebire de protoni, neutroni nu au nici o sarcină electrică, adică taxa lor electrică este zero. În consecință, cunoscând numărul de elemente de bază, este imposibil să spunem cu certitudine cât de mulți neutroni conținute în nucleul său. De exemplu, în atomii de carbon nucleu conține invariabil 6 protoni, protoni deși poate fi 6 și 7. Variații elementelor chimice nuclee cu un număr diferit de neutroni in nucleu se numesc izotopi ai acelui element. Izotopi poate fi atât naturale, cât și nefiresc obținute.
2. nucleu nuclear desemnat simbolul alfabetic al unui element chimic din tabelul periodic. La dreapta simbolului în partea de sus și în partea de jos există două numere. Numărul de sus A - este numărul de masă al atomului, A = Z + N, unde Z - taxa nucleară (numărul de protoni) și N - chisloneytronov. Numărul de jos - este Z - taxa a nucleului. Această înregistrare oferă informații cu privire la numărul de neutroni din nucleu. Aparent, este egală cu N = A-Z.
3. Diferite izotopi ai unui element chimic O serie de modificări, care se reflectă în înregistrarea acestui izotop. Anumiți izotopi au numele lor reale. De exemplu, un nucleu de hidrogen obișnuit nu are un neutron și un proton. Izotopilor de hidrogen deuteriu este un neutron (A = 2) și izotop tritiu - doi neutroni (A = 3).
4. Numărul Relatedness de neutroni înregistrate de numărul de protoni la N-Z diagrama miezuri nucleare. Stabilitatea nucleelor depinde de raportul dintre numărul de neutroni și numărul de protoni. Miezuri nuclides lumină deosebit de stabilă când N / Z = 1, adică cu un număr egal de neutroni și protoni. Odată cu creșterea numărului de schimburi de regiune de stabilitate în masă la valorile N / Z> 1, atingând o valoare de N / Z
1.5 pentru nuclee deosebit de grele.
Un atom al unui element chimic compus dintr-un nucleu și înveliș de electroni nucleare. Compozitia miezului nuclear include două tipuri de particule - protoni și neutroni. Aproximativ o masă atomică este concentrată în miez, așa cum protoni și neutroni sunt mult mai grele decât electroni.

- numărul elementului atomic, N-Z diagrama.
instrucție
1. Neutronii nu au nici o sarcină electrică, adică taxa lor electrică este zero. Aceasta este principala dificultate în determinarea numărului de neutroni - numărul nuclear al elementului sau învelișul său electronic nu dă un rezultat clar în această privință. De exemplu, în atomii de carbon nucleu conține invariabil 6 protoni, protoni deși poate fi 6 și 7. Variații elementelor chimice nuclee cu un număr diferit de neutroni in nucleu se numesc izotopi ai acelui element. Izotopi pot fi naturale sau pot fi preparate și nenatural.
2. Nucleele atomilor desemnat simbolul alfabetic al unui element chimic din tabelul periodic. La dreapta simbolului în partea de sus și în partea de jos există două numere. Numărul de sus este A - este numărul de masă al atomului. A = Z + N, unde Z - taxa nucleară (numărul de protoni) și N - numărul de neutroni. Numărul de jos - este Z - taxa a nucleului. Această înregistrare oferă informații cu privire la numărul de neutroni din nucleu. Aparent, este egală cu N = A-Z.
3. Diferite izotopi ai unui element chimic O serie de modificări care sunt permise să fie văzut în înregistrarea acestui izotop. Anumiți izotopi au numele lor reale. De exemplu, un nucleu de hidrogen obișnuit nu are un neutron și un proton. Izotopilor de hidrogen deuteriu este un neutron (A = 2, figura 2 de mai sus, de jos 1) și tritiu a izotopilor - doi neutroni (A = 3, figura 3, de mai sus, sub 1).
4. Relatedness neutronilor din numărul de protoni se reflectă în așa-numitele diagrama miezuri nucleare N-Z. Stabilitatea nucleelor depinde de raportul dintre numărul de neutroni și numărul de protoni. Miezuri nuclides lumină deosebit de stabilă când N / Z = 1, adică cu un număr egal de neutroni și protoni. Odată cu creșterea numărului de schimburi de regiune de stabilitate în masă la valorile N / Z> 1, atingând o valoare de N / Z
1.5 pentru nuclee deosebit de grele.
Pentru a detecta numărul de protoni din atomul determina poziția în tabelul periodic. Descoperiți numărul său de serie în tabelul periodic. Acesta va fi egal cu numărul de protoni din nucleul nuclear. Dacă studiem izotopului, uita-te la o pereche de numere care descriu proprietățile, numărul de jos este egal cu numărul de protoni. În acest caz, în cazul în care celebra taxa a miezului nuclear, a permis să se cunoască numărul de protoni prin împărțirea valorii la taxa de un proton.
- Pentru a detecta numărul de protoni pentru a afla valoarea de protoni sau electroni încărcați, o luați un tabel de izotopi, tabelul periodic.
instrucție
1. Determinarea numărului de protoni atoma.V din apropiere atunci când celebrul atom care este studiat, poate descoperi locația sa în tabelul periodic. Identificați numărul din tabel pentru a găsi o celulă a elementului corespunzător. In celula detecta numărul de serie al elementului, cea care corespunde înțelege atomul. Acest număr de serie va corespunde cu numărul de protoni din nucleul nuclear.
2. Cum de a detecta protoni în izotopii izotope.Mnogie de atomi au mase nuclee diferite. În consecință, este doar masa nucleului este nesatisfăcător pentru o determinare neambiguă a miezului nuclear. În prezentarea izotopul înainte de a înregistra denumirea chimică a înregistrat în mod constant o pereche de numere. Numărul superior indică masa atomului în unități de masă nucleare, iar partea de jos indică sarcina nucleului. Întreaga unitate responsabilă cu nucleu astfel de intrări corespunde un proton. Astfel, numărul de protoni egal cu numărul mai mic de intrări într-un anumit izotop.
3. Cum de a detecta protoni știind yadra.Zachastuyu încărcați proprietăți ale nucleelor atomilor se caracterizează prin sarcina sa. Pentru a comanda pentru a determina numărul de protoni în ea, trebuie să-l traducă în pandantive (în cazul în care el a servit în mai multe unități). Apoi, împărțiți taxa pe modulul de bază de încărcare de electroni. Acest lucru se datorează faptului că la acel atom este electric neutru, numărul de protoni din ea fiind egal cu numărul de electroni. Și tarifele lor sunt egale în mărime și în semn opus (proton are taxa corespunzătoare a electronului - negativ). În consecință responsabil de decalajul atom nuclee de numărul de 1,6022 • 10 ^ (- 19) pandantiv. Acest lucru va avea numărul de protoni. Din faptul că metodele de măsurare de încărcare atomică în mod satisfăcător precis, în cazul, în cazul în care divizia sa transformat un număr fracționar, se rotunji la întreg.
Atomii constau din particule subatomice - protoni, neutroni și electroni. Protonii sunt încărcate în mod corespunzător particulele care se află în centrul atomului în miezul său. Se calculează numărul de protoni permis numarul nuclear izotop al elementului chimic corespunzător.
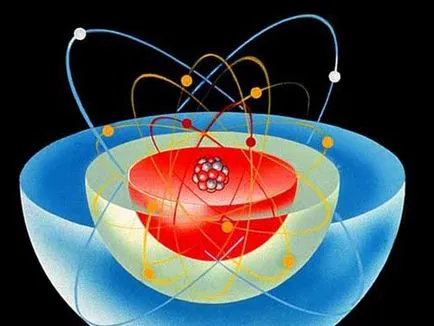
model de atom
Pentru a explica proprietățile atomului și se aplică modelul său de proiectare, cu siguranță, sub numele de „modelul Bohr al atomului“. În conformitate cu acest design atom amintește de un sistem clar - un centru important (nucleu) este în centru, iar cele mai multe dintre particulele de lumina se misca intr-o orbită în jurul acestuia. Neutronii și protonii formează nucleul încărcat pozitiv și electronii încărcați negativ se deplaseze în jurul unui centru, fiind atrași de ea prin silami.Elementom electrostatic numita substanță constituită din atomi de un singur tip, este determinată de numărul de protoni din toate acestea. Componenta este atribuit numele și simbolul său, de exemplu, hidrogen (H) sau oxigen (O). Proprietățile chimice ale unui element depinde de numărul de electroni și, în consecință, numărul de protoni conținute în atomi. atom chimice kollyatsii nu depind de numărul de neutroni, deoarece neutroni nu au nici o sarcină electrică. Totuși numărul lor influențează stabilitatea nucleului schimbare generală masă atomică.
Izotopi și numărul de protoni
Izotopii atomilor sunt numite elemente individuale cu un număr diferit de neutroni. Acești atomi sunt chimic aceeași greutate proprie, oricât de diferite, ele diferă în capacitatea lor de a emite numărul de izluchenie.Yaderny (Z) - este numărul secvențial al elementului chimic din sistemul periodic, este determinată de numărul de protoni din nucleu. Toate Numărul nuclear atom caracterizat și numărul de masă (A), care este egal cu numărul total de protoni și neutroni din nucleu. Elementul poate avea un număr diferit de atomi cu neutroni, dar numărul de protoni rămâne ferm și este egal cu numărul de electroni ai unui atom neutru. Pentru, în scopul de a determina cât de mult de protoni conținute în nucleul izotopului, destul să se uite la numărul său nuclear. Numărul de protoni egal cu numărul elementului chimic corespunzător din tabelul periodic.
Ca un exemplu, izotopii hidrogenului este lăsat să se vadă. In natura, atomii de hidrogen sunt deosebit de frecvente cu un proton și nu neutroni. În același timp, există izotopi de hidrogen, cu unul sau doi neutroni, au referințe corespunzătoare. Cu toate acestea toate au un singur proton, care corespunde numărului ordinal de hidrogen din tabelul periodic. izotopi de hidrogen, cu un număr de masă de neutroni și 2 sunt numite hidrogen greu sau deuteriu, este stabil. Tritiul este un izotop al hidrogenului cu numărul de masă 3 și doi neutroni, radioactive. Sa numit uneori hidrogen super-grele și nucleul de tritiu - Triton.
a se vedea, de asemenea,
- Cum de a determina coeficientul de frecare

- Cum de a găsi puterea de frecare de alunecare

- Cum să plătească pentru concediu pentru îngrijirea unui copil de până la 3 ani

- Cum de a modifica haina de piele
