constant echilibrul de solubilitate eterogeni
Conform teoriei electroliți puternici, atunci când solide dizolvate ale căror cristale sunt construite de ioni nu este molecula, iar ionii care formează rețeaua cristalină în soluție. Prin urmare, într-o soluție saturată de astfel de compuși se stabilește un echilibru între ionii au trecut în soluție și o fază solidă (precipitat) solutului. În acest caz, două proces de curgere opuse reciproc: ionii din precipitatul se deplasează în soluție (dizolvare) și se precipită din soluție (cristalizare).
soluții saturate de electroliți greu solubili sunt foarte diluate. Puterea lor ionică este mică, deci putem presupune că coeficienții de activitate a ionilor de electroliți în soluție sunt egale cu unitatea și propria lor activitate cu concentrații molare identice numeric.
Puțin solubilă soluție de sare de argint, soluție saturată de clorură între AgCl precipitat și ionii fiind în fază lichidă și Ag + Cl - echilibrul eterogen mobil este stabilit:
AgCl (m) Ag + (p) + Cl - (p)
Conform legii acțiunii masei, cantitativ se caracterizează prin constanta de echilibru:
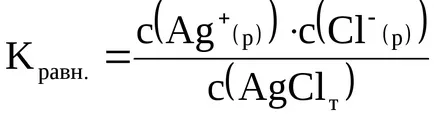
Prin eliminarea fracțiunii, expresia Kravn. poate fi scris după cum urmează:
Deoarece concentrația de solid c (AgCl (t)) este constantă, atunci partea stângă a acestei ecuații cu condiții externe constante (temperatură, presiune), va fi, de asemenea, constantă. Produsul acestor constante (Kravn × c (AgCl (t)).) Se numește inachekonstantoy solubilitatea și oboznachayutKs (subscript «s» de Engl solubilitate - solubilitate.):
În literatura rusă este adesea folosit în locul constantei de solubilitate numită „produsul de solubilitate“ și oboznacheniePR iliKPR
În prezent, denumirea de PR și Katt. recomandările IUPAC nu sunt adecvate să se aplice.
Din expresia constantele de solubilitate rezultă că există o constantă la o temperatură dată într-o soluție saturată de produs electrolit solubil din concentrația molară a ionilor săi.
Dacă mai mulți ioni identici formați prin disociere a electrolitului unității formula, de exemplu:
Ca3 (PO4) 23Ca 2+ + 2PO4 3-,
când KS calculează concentrația de echilibru molară a fiecărui ion este ridicat la o putere egală cu raportul stoichiometric, care stă în fața ionului ecuația de disociere dată
Un astfel de produs a concentrațiilor molare ale ionilor în viitor vor nazyvatstehiometricheskim munca.
Astfel, pentru orice electrolit solubil
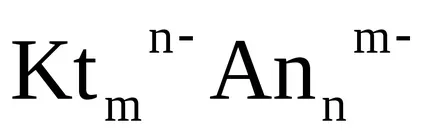
Constantele de solubilitate, precum și toate echilibrului constant, temperatură dependentă, deci în cărțile de referință care sunt adesea date pentru condiții standard (T = 298K și p = 101.325 kPa) (Tabel. 14).
Tabelul 14. Constantele de solubilitate a anumitor substanțe ușor solubile la T = 298 K