Conductivitatea electrică a soluțiilor electrolitice
În absența unui câmp electric extern ionii sunt în soluție în mișcarea termică aleatoare continuă. Atunci când apare o diferență de potențial, acestea dobândesc mișcarea direcțională de la un pol la altul, cationi și anioni se deplaseze în direcții opuse. Astfel, un curent electric. Spre deosebire de metale, care sunt caracterizate printr-un mecanism electronic al conductivității electrice în soluții electrolitice electricitate este transferat prin deplasarea ionilor. Prin urmare, electroliți atribuite conductorii de al doilea tip.
Caracteristicile cantitative ale capacității sistemului de a conduce curentul electric - o conductivitate electrică. Unitatea de conductivitatea electrică a soluțiilor de electrolit este conductivitatea electrică specifică - reciproca rezistivității:
. [Ohm -1 m -1 = A se vedea m -1]
în care r - rezistivitate
;
R - rezistența totală a conductorului, în ohmi;
l - lungimea conductorului în metri;
s - conductor secțiune transversală m 2.
conductivitate electrică specifică a soluției de electrolit - o soluție conductivitate electrică a volumului între cei doi electrozi paraleli având o suprafață de 1 m 2 și distanțate de 1 m unul de celălalt.
dependent de conductivitatea electrică specifică
- viscozitate și constantă dielectrică a solventului;
- viteza de mișcare a ionilor, care depinde de mărimea încărcăturii ionice și raza acesteia cu hidratarea.
Prin creșterea conductivității concentrației de electrolit crește inițial și apoi scade. O astfel de dependență este caracteristică atât electroliți puternici și slabi. Acest lucru se datorează electroliții slabi reducerea gradului de disociere, cât și pentru cei puternici - interacțiunea electrostatică dintre ionii.
Alături de conductivitatea utilizată în conductivitate electrică molar electrochimie # 955; - conductivitate electrică, sa referit la numărul de moli de solut la 1 m 3 a soluției:
unde V - diluare (volumul soluției, în care electrolitul conține 1 mol).
Pentru ca unitatea de calcul practic pot fi utilizate instrumente derivate, de exemplu, prin exprimarea unei concentrație în mol / relație molară dm 3 între conductivitatea electrică și este exprimată prin ecuația:
conductivitate electrică Molar volumului soluție de electrolit egală cu conductivitatea electrică a soluției de electrolit care conține 1 mol de solut, și plasat între doi electrozi paraleli suprafață 1m 2. spațiate 1 m unul de celălalt.
Fig. Curba I corespunde unui electrolit puternic, curba II - electrolit slab.
Conductivitatea Molar scade mereu cu creșterea concentrației de electrolit datorată interacțiunii electrostatice dintre ionii. Cei mai mulți ioni în soluție, este mai scurtă distanța dintre ionii și interacțiunea mai puternică, astfel, ionii se interferează unul cu altul pentru a muta. Cu o creștere molar de diluție crește conductivitatea, și la 0 C ® tinde la o valoare limită # 955; ¥. (# 955; ¥ - limitarea conductivitate electrică molar). Deoarece interacțiunea soluție extrem de diluata dintre ionii este absent, putem presupune că fiecare ion se mișcă independent de alți ioni la viteză maximă.
În contextul legii limitarea diluției unei mișcări independente a ionilor - legea Kohlrausch. în care conductivitatea molară limitare a soluției de electrolit egală cu suma conductivitățile molar de cation și anion la diluție infinită:
,
unde - limitarea conductivitate (mobilitate), cation și anion.
mobilitate ionică mărime electrică caracteristică care transferă ioni și determinat de viteza absolută a mișcării (adică viteza de mișcare la un câmp electric de 1 V / m):
;
,
unde F - Faraday număr F = 96480 C / mol;
. - viteza absolută a mișcării cation și anion în soluție o concentrație dată și la o diluție infinită, respectiv.
Viteza absolută a ionilor este mai (4 ¸ 8) 10 -8 m 2 / (B x c). Singurele excepții sunt ionii H + și OH -. viteza absolută a mișcării, care sunt foarte mari.
Viteza absolută a cationi și anioni nu sunt aceleași, proporția de electricitate transportată de către ionii pot varia. Pentru caracterizarea este utilizată cantitatea de electricitate transportată de către acest tip de număr de transport ionic. Număr de transport - este raportul dintre cantitatea de energie electrică transferată acestui tip de ioni la cantitatea totală de energie electrică a soluției de electrolit transferat. cation de numere de transport t anioni T- + și poate exprima conductivitatea electrică:
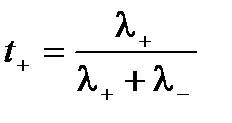
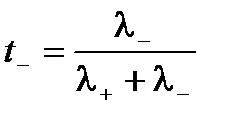
Astfel, numărul de transport - este mobilitatea relativă a ionilor. Suma transferului cationi și anioni
.
Efectul interacțiunii ion-ion de conductivitatea electrică a soluției reflectă raportul dintre fl conductivitate electrică:

Relația poate fi exprimată prin ecuația de l fl și gradul de disociere a unui:
.
Pentru soluțiile de electroliți slabe interacțiune ion-ion pot fi neglijate, atunci fl »1, atunci
ceea ce implică
.
Astfel, prin măsurarea conductivității o anumită concentrație a soluției poate determina gradul de disociere a electrolitului. valoare # 955; ¥ poate fi calculată prin ecuația Kohlrausch pe baza datelor de referință sau determinate experimental. Pentru această conductivitate electrică măsurată a slabi soluțiile electrolitice de diferite concentrații. În conformitate cu legea de diluare a Ostwald
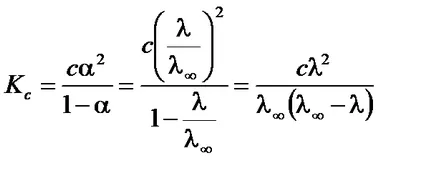
Ecuațiile la o formă liniară, divizarea una în părți stânga și la dreapta:
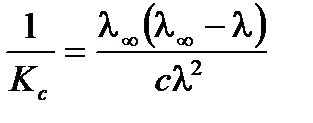
.
.
Se obține ecuația de tip liniar. în cazul în care. . . . pentru a determina # 955; ¥ Kc și reprezentate grafic în coordonate. în conformitate cu. . .
dependență slabă a conductivității asupra concentrației soluției de electrolit poate fi exprimată prin ecuația Ostwald. Pentru o soluție slabă electrolit binar (a <<1) в соответствии с законом разбавления Оствальда получим:
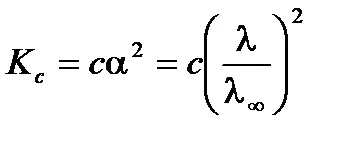
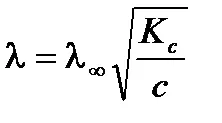
Din ecuația rezultă că conductivitatea molară a soluției de electrolit slab scade odată cu creșterea concentrației.
Pentru electroliți puternici # 945; ≈ 1. Atunci
;
,
în consecință, valoarea unei concentrări soluție dată poate fi calculată conductivitatea electrică conductivitate electrică.
Dependența conductivității molară a soluției de electrolit din Onsager concentrare puternică exprimată de ecuația:
,
unde a și b - coeficienți teoretice în funcție de constanta dielectrică a solventului, viscozitatea solventului și temperatura.
După cum se vede din ecuația Onsager, cu creșterea concentrației de electrolit conductivitatea electrică a soluției scade.
Odată cu creșterea temperaturii conductivitatea soluției de electrolit crește. Acest lucru se datorează unei scăderi a vâscozității soluție cu creșterea temperaturii și creșterea vitezei de deplasare a ionilor, și pentru electrolitii slabi crește pe măsură ce gradul de disociere.