Compararea proprietăților aldehide și cetone
Ca aldehide și cetone se pot atașa hidrogen, acid cianhidric, organomagnezieni, hidrosulfit de sodiu. Din cetone cu hidrosulfit de sodiu reacționează numai acelea care conțin metil sau metilen grupe de câte doi imediat adiacent la carbonil. Deoarece hidroxilamină, hidrazină și aldehide și cetone derivate reacționează pentru a forma oxime, hidrazone și phenylhydrazones t. D. Acțiunea halogenurile de fosfor și sulf de oxigen în moleculele de aldehide și cetone substituite cu doi atomi de halogen.
Cu toate acestea, există diferențe semnificative între aldehide și cetone. Astfel, spre deosebire de cetone, aldehide nu colorate cu soluție de acid fucsin a fost incoloră, nu se condensează sub acțiunea alcaliilor în condiții blânde care nu dau acetali cu alcooli, nu dau o reacție oglindă de argint.
Cetone oxidat mai greu decât aldehide, în care are loc oxidarea când ruperea legăturii carbon-carbon; cetone dificil să apară și reacția de condensare; cetone dau o reacție de culoare cu nitroprusiat de sodiu.
Conceptul de aldehide nesaturate și cetone
Din această clasă de compuși de interes special # 945;, # 946; -nepredelnye compuși oxo conținând sistem conjugat de obligațiuni și cetenă.
Dacă legătura dublă carbon-carbon este separat de gruparea carbonil de mai mult de o singură legătură C-C, molecula conține două grupuri independente, o influență mică unul față de celălalt.
aderarea la # 945;, # 946; -nepredelnym conexiune apare cel mai frecvent în poziția sistemului 1,4-conjugat. Trebuie amintit că densitatea maximă de electroni este un atom de oxigen mai electronegativ, care definește procedura de aderare.
Ketenes - compus inițial asemănător cetone structural nesaturați și alene.
Cetenă - primul dintr-o serie de ketenes. Un gaz cu un miros înțepător. În cantități mari produse prin piroliza acetonă:
Cetenă nu prezintă proprietățile obișnuite ale cetonelor - nu dă oximă, fenilhidrazona, diferă un mare înclinație pentru reacții de adiție. Se formează un dimer la depozitare.
Caracteristici ale proprietăților de sinteză și chimice ale quinonele
Chinone - clasă specifică de compuși carbonilici nesaturați ciclice având un sistem de legătură conjugat.
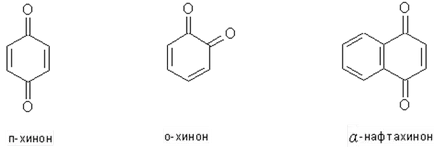
Chinone sunt formate ușor prin oxidarea fenoli dihidrici, structura corespunzătoare. (A se vedea. Oxidarea fenoli).
1. chinone sunt substanțe foarte reactive, reducerea ușor convertite înapoi în fenoli diatomice

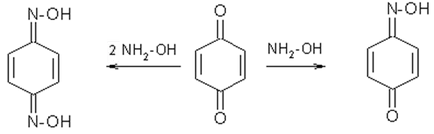
2. chinone cu clorhidrat de hidroxilamină la mono- și dioximes forma:
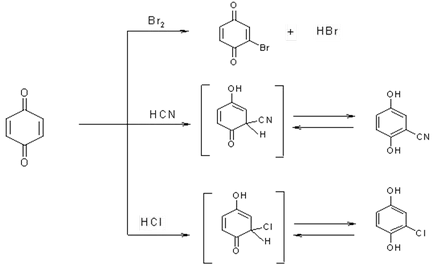
3. În majoritatea reacțiilor de quinonele se comporta ca # 945, # 946; -nepredelnye cetone atașate varietate de reactivi (halogenuri, amine, alcooli, acizi organici, etc.).
4. Ca dienofilei, chinone reacționează sinteza diene:
Sarcina de auto-evaluare
1. Nume următorii compuși prin nomenclatoarelor cunoscuți ai:
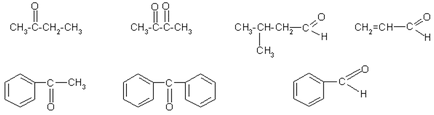
2. Scrieți formulele structurale ale următorilor compuși: acetonă, # 946; -hlormaslyany aldehidă oximă ciclopentanonă; dimethylpropanal; hidrazonă propanona; 4-formiltsiklogeksanon.
3. Primirea acetaldehida: dintr-un alcool, a acidului de digalogenoproizvodnogo din alchine.
4. Scrieți toate tipurile de reacții de adiție nucleofilă la carbonil prin exemplul propanal.
5. Reacții de condensare Write, care sunt caracteristice aldehidelor alifatice (butanal) și aldehidă aromatică (n-tolualdehidă).
6. Se descrie tautomerie Floroglucinol ceto-enol și cauzele ei.
6.5. Unul și polibazici acizii carboxilici și derivații lor: definiție, izomerie, nomenclatura
Acidul carboxilic organic caracterizat prin prezența grupărilor carboxil # 9472; COOH. După numărul acestor grupuri se disting acizii mono-, di- și polibazici, în general. Acizii organici pot fi alifatici (saturate și nesaturate), aliciclic, aromatic.
Nomenclatura și izomerie
carboxilic structură definită radical izomerism, legat la gruparea carboxil.
Conform acidului din nomenclatura IUPAC numita închidere corespunzătoare, cu adaos de hidrocarburi și cuvinte -ovaya de catenă acid, în care numerotarea începe cu carbonul grupării carboxil. Cu toate acestea, în cele mai multe cazuri, utilizați nume comune.

Uneori, în compilarea acizilor names raționale cu carbon cu catenă ramificată, ele sunt considerate ca fiind derivați ai atomilor de acid acetic într-o moleculă în care atomii de hidrogen ai grupării metil substituiți cu radicali, cum ar fi:

1. Oxidarea compușilor organici (hidrocarburi, alcooli, aldehide, cetone):
2. Hidroliza nitrilului
3. Acțiunea dioxidului de carbon asupra compușilor organometalici:
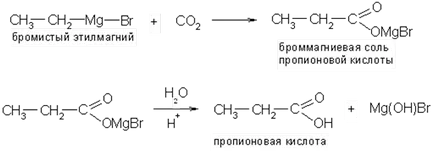
4. oxo. Reacția olefinelor cu monoxid de carbon (II) și abur în prezența catalizatorilor (tetracarbonil nichel, acid fosforic etc.) La o temperatură de 300-400 0 C și o presiune de 2-5 # 8729, 10 7 Pa dă un amestec de normal și acizi cu lanț ramificat:
5. trigalogenoproizvodnyh Hidroliza conținând halogen la un atom de carbon:
6. Acizii aromatici pot fi preparați prin oxidarea omologi benzen:
7. Mai mult, acidul carboxilic aromatic poate fi preparat:
a) fuziunea formiați aromatice și sulfați cu cianurile
b) reacția compușilor aromatici cu derivați halogenați ai acidului carbonic:

În funcție de structura de acid carboxilic sunt lichide sau solide. Reducerea lungimii scheletului de carbon sau apariția unor grupuri suplimentare de acid carboxilic crește solubilitatea apei. Proprietăți fizice care influențează acizii asocierea moleculelor prin formarea de legături de hidrogen. Acizii pentru a forma legături de hidrogen mai puternice decât alcooli, datorită O # 9472; H-le în mare parte polarizată. In solid, lichid și chiar într-o oarecare măsură, în stare de vapori există acizi carboxilici ca dimerii:
Acizii aromatici se fierb la ceva mai mari și se topesc la temperaturi mult mai mari decât acizii grași cu același număr de atomi de carbon. Soluțiile apoase ale acizilor monocarboxilici aromatici prezintă un grad mai mare de disociere decât acidul gras: benzoic constantă de disociere acidă a 6,6 # 8729; 10 -5. Acid acetic 1,75 # 8729; 10 -5.
Caracterul acid al acizilor carboxilici este pronunțat. Acest lucru se datorează influenței reciproce a atomilor în grupa carboxil: în ea, densitatea de electroni este deplasată spre cel mai de electroni atomului de oxigen

Acest lucru slăbește legătura dintre oxigen și hidrogen și facilitând separarea ionilor de hidrogen, adică disociere acidă.
Apariția de joasă densitate de electroni (# 948 +) la atomul de carbon central al grupării carboxil, de asemenea, duce la contracție # 963, electroni legătură adiacentă carbon-carbon la gruparea carboxil și apariția densității de electroni scăzută (# 948 +) în # 945 Acid atom de carbon.
Deplasarea densității de electroni în molecula de acid carboxilic nedisociat scade densitatea de electroni pe atomul de oxigen al grupării hidroxil și carbonil pe ea crește. Această schimbare este mai crescută în anionul de acid.
Rezultatul este trecerea de egalizare completă a taxelor în anionului, se karboksilaniona din titlu mesomerism. Densitatea de electroni Alinierea conduce la un câștig în energie și pentru multe reacții este forța motrice, numită energia de rezonanță.
Prezența substituenților electrofili în radicalul, în special # 945 poziții, legături duble, sau apariția celei de a doua grupe carboxil conduce la o creștere a caracterului de acid.
1. Acizii carboxilici pot forma săruri cu metale, oxizii lor și hidroxizi, amoniac:
2. reacția caracteristică a acizilor carboxilici este capacitatea lor de a forma cu alcooli în prezența esterilor acizilor minerali - reacția de esterificare:
Rolul unui catalizator în reacțiile de esterificare joacă ioni de hidrogen. Mecanismul de reacție de esterificare este descrisă după cum urmează:
a) oxigenul grupării carbonil a acidului, capturarea unui proton, formează un carbocation I:
I carbocationului ataseaza molecula de alcool din cauza perechilor de electroni singuri ale atomului de oxigen pentru a forma un complex tetraedric intermediar II, care este capabil cu apă pentru a reversibil dezintegra și formează un ester carbocation nou clivaj III. ester format, eliberat catalizatorul de disociere proton în sfârșit.
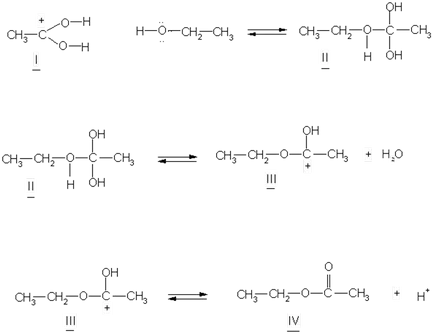
De mare interes este hidroxilul acidă întrebare sau alcool scindat în reacții de esterificare.
Folosind „trasor“ (izotop oxigen greu 18 O) a arătat că apa de esterificare formată de alcool hidrogen și acid hidroxil:
Esterii sunt de asemenea preparate prin reacția cu alcooli și alcoolați galogenatsilov și săruri ale acizilor carboxilici cu halogenuri de alchil și acțiunea de încălzire a alcoolilor asupra anhidride acide:
Esterii alcoolilor inferiori și acizi - lichid cu un miros plăcut, în unele cazuri asemănătoare cu mirosul fructelor. De exemplu: izoamil - esență de pere.
Pentru hidroliza esterului tipic și reacția de transesterificare:
3. Sub acțiunea halogenurilor de fosfor și sulf halogenuri ale acizilor carboxilici se formează acizi. În acest caz, ca și în cazul alcoolilor substituiți cu hidroxil halogen:

halogenuri acide pot fi numite cu acid și halogen, de exemplu butiric bromură acidă. Dar cel mai adesea ele sunt numite radicali acizi - acil. Înainte indică și numele de acil halogen:
halogenuri inferioare - un lichid cu un miros foarte înțepător, iritant membranele mucoase.
Galagenangidridov Prin reacția cu compuși care conțin un atom de metal sau un atom de hidrogen activ este înlocuit fragmentul acid - acil. Astfel de reacții de acilare sunt chemați să primească și să permită tuturor derivaților de acid: anhidride, acizi, esteri, amide, peroxizi, etc.
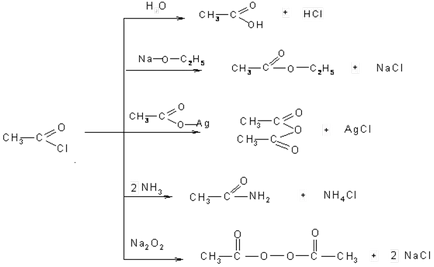
Toate aceste reacții sunt reacții de substituție nucleofilă și sunt în cele mai multe cazuri de mecanism tetraedru.
4. deshidratant acizi sau săruri acide prin reacția lor cu anhidride, se formează halogenuri acide:
anhidride acide ale inferior - cu un lichid electric de miros înțepător; în apă sunt slab solubile sau insolubile. Se fierbe la o temperatură mai mare decât acidul corespunzător.
anhidride acide au o reactivitate ridicată și sunt halogenuri, agenți de acilare bun:
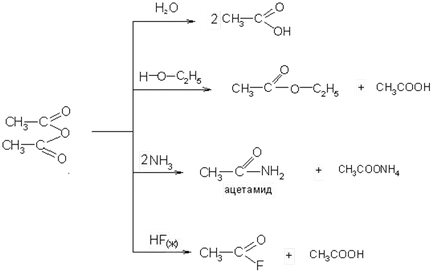
De mare importanță este reacția de producere a fluorurii.
5. La trecerea vaporilor de acizi cu amoniac în prezența unui catalizator obținut prin deshidratarea amidele acizilor:
amide acide preparate ca efect NH3 asupra halogenuri sau anhidride acide sau săruri de amoniu ale acizilor:
amide acide - substanțe cristaline (cu excepția amidice lichid acid formic - formamida).
Amidele, prin împerechere perechea de electroni fără azot cu oxigen carbonil, aproape nici proprietăți de bază
Cel mai important pentru reacția amidelor sunt:
a) hidroliza într-un mediu acid sau alcalin
b) deshidratarea în prezența pentoxidului de fosfor
Pe nitrili detalii acizii vezi capitolul „compus care conține azot.“
6. Acizii substituiți cu halogen pot fi preparați prin acțiunea clorului molecular sau acid carboxilic brom. cel mai ușor # 945; halosubstituit derivati sunt formate din acizi anhidride și halogenuri: