cataliza omogenă și heterogenă
Reacțiile catalitice omogeni sunt larg distribuite în natură. Un exemplu de procese catalitice omogene industriale pot servi reacția de esterificare, saponificarea esterilor și așa mai departe. D.
Mecanismul de acțiune catalitică pentru cataliza omogenă este formarea de compuși reactivi între catalizator și intermediarii, care, în unele cazuri chiar posibil să se aloce. Accelerarea reacției, în cele mai multe cazuri are loc prin reducerea energiei de activare. Când cataliză omogenă în soluție poate avea un efect catalizator ionilor de hidrogen, hidroxil, săruri precum și substanțe care promovează formarea de radicali liberi.
Cataliza prin acțiunea ionilor de hidrogen sau hidroxil numita acid - bazic. Acest tip de cataliză este cea mai comună. Esența ei constă în trecerea unui proton din catalizator la reactanți (cataliză acidă) sau reactantului la catalizator (cataliza bază). Ulterior proton se deplasează în direcția opusă și catalizatorul regenerat.

Rata reacțiilor catalitice omogene, este influențată de mai mulți factori: activitatea catalizatorului, temperatura, concentrația catalizatorului, sub agitare. Viteza de multe reacții catalitice depinde de concentrația catalizatorului. La valori mici ale randamentului produsului x Scat pentru perioada dată de timp de aproximativ proporțională cu concentrația catalizatorului, dar cu o curbă creștere suplimentară a Scat devine amortizată
reacție catalitică în fază lichidă se realizează de obicei în reactoare cu dispozitivele de amestecare.
cataliza heterogenă
Dezavantajul major al cataliză omogenă a catalizatorului este dificultatea de izolare a amestecului final de reacție, în care catalizatorul este pierdut irevocabil produsul contaminat cu ei. Prin urmare, mult mai popular a fost cataliza heterogenă.
Pe baza unei faze sunt cunoscute diferite tipuri de cataliză eterogenă: catalizatori lichizi care accelerează reacția dintre lichide nemiscibile (sau lichide și gaze) și catalizatorii solizi, care accelerează reacția dintre lichidele sau gazele. Cele mai multe reacții catalitice - o reactie de gaz care implică catalizatori solizi. Cataliză teoriilor existente comune tuturor teoriilor este formarea pe suprafața catalizatorului solid catalizator intermediar de tip adsorbție care implică electroni.
Catalizatorii sunt de obicei solide poroase având o suprafață internă foarte dezvoltată. Toate procesul catalitic pe un catalizator poros solid poate fi reprezentat sub forma a cinci etape separate:
Difuzia reactantilor din fluxul de la suprafața granulelor de catalizator și în porii existenți în cereale.
adsorbție activată (chemisorption) pe suprafața catalizatorului, pentru a forma compuși de reactiv intermediar - catalizator.
Rearanjarea atomilor pentru a forma un produs intermediar - catalizator.
Desorbția produsului de pe suprafața catalizatorului.
Difuziunea produsului de pe suprafața catalizatorului în interiorul porilor primul și cel mai târziu de la suprafața cerealelor din debitul total.
Rata totală a procesului catalitic global este limitată de cel mai lent dintre pașii. Dacă acest pas este unul dintre etapele de difuzie, cataliză are loc în regiunea de difuzie. Și distinge regiunea de difuzie internă și externă. Dacă lent este 2, 3 sau 4 etape, procesul se întoarce la regiunea cinetică.
Ecuația generală a vitezei procesului catalitic în regiunea catalitică,
,
unde
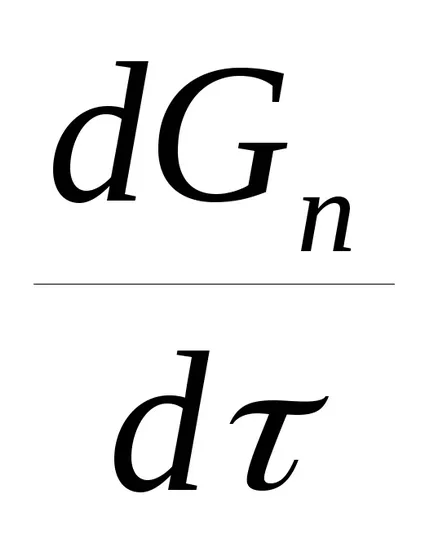
k0 - factor pre-exponențial în ecuația Arrhenius;
V - volumul în vrac a catalizatorului;
e - principalul logaritmul natural;
ΔS - forța motrice a procesului la presiune atmosferică;
P1 - presiunea adimensionale, adică raportul de presiune reală la cea atmosferică; ..
n - ordinea reacției.
In domeniul proceselor cinetice apar la catalizatori inactivi cu dimensiuni mici de cereale și pori mari în regim de curgere turbulentă reactivii și temperaturile scăzute.
În cazul în care procesul merge de către câmpul magnetic extern. viteza determinată de coeficientul de difuzie al reactanților și produșilor de reacție. Conform legii, Fick
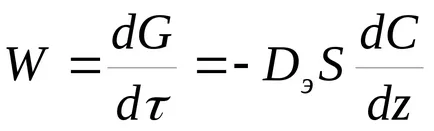
unde De - coeficientul de difuzie efectivă;
S - suprafața liberă a granulelor de catalizator;
Z - direcția perpendiculară pe suprafața.
În domeniul proceselor de difuzie externe să aibă loc în activitatea catalizatorului. Pentru a accelera viteza de curgere ridicată utilizarea de proces.
In intradiffusion rata totala zona a procesului catalitic este limitată de viteza de difuzie a reactanților și a produșilor de reacție în porii granulelor de catalizator. procese catalitice în domeniul intradiffusion poate accelera granule de catalizator de reducere și raza crescută a porilor, dar numărul acestora este redus și în consecință a suprafeței.
Cele mai importante caracteristici ale catalizatorului sunt:
1. Temperatura de aprindere - temperatura minimă a amestecului de reacție în care procesul începe să aibă loc cu o viteză suficientă pentru scopuri practice. Cu cât este mai activ catalizatorul, este mai scăzută temperatura de aprindere. Acest lucru este foarte important atunci când se efectuează reacții reversibile exoterme de tip A = R + Q. deoarece este posibil să se mărească gradul de conversie.
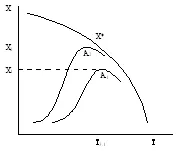
Gradul de conversie X reacție reversibilă exotermă în funcție de temperatură pentru catalizatorii A2> A1 activitate diferită
Astfel, este posibilă reducerea preîncălzirea reactanților.
Timpul de contact - timpul de contact al reactanților cu catalizatorul. determinat
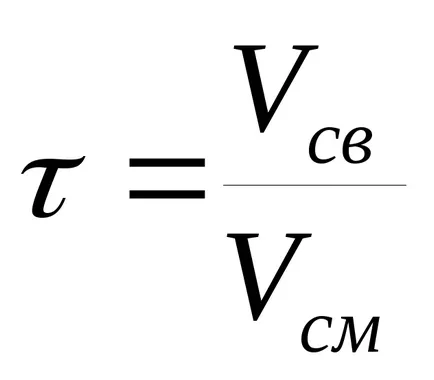
unde Vsv - fără catalizator volum m 3;
Vb - volumul amestecului de reacție care trece prin catalizator m 3 / s.
Cel mai adesea folosesc timpi de contact fictive
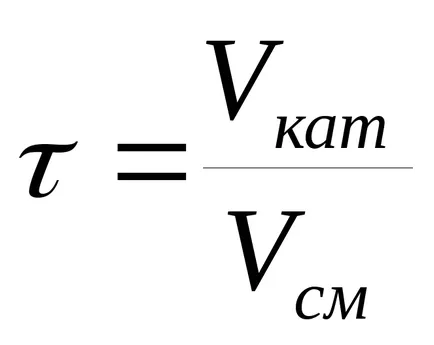
în care Vkat - catalizator volum m 3.
Inversul timpului de contact, numit viteza spațială - volumul amestecului de reacție care trece prin unitatea de timp.

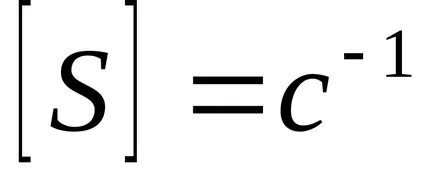
Prin creșterea viteza spațială, conversia scade în general, dar apoi crește intensitatea aparatului, adică. E. Crește cantitatea de produs dorit produs per unitate de volum de catalizator per unitate de timp. Acest lucru se datorează faptului că o creștere a vitezei de curgere a amestecului de reacție este departe de echilibru și forța motrice ΔS mare.
Ca un exemplu, datele privind influența viteza spațială asupra vitezei de proces de sinteză a amoniacului catalitic
Intensitatea catalizatorului este exprimată ca ecuația
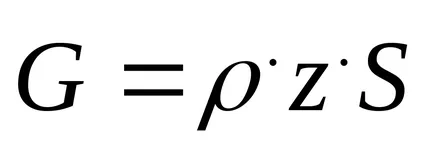
unde G - productivitatea catalizatorului, kg m -3 h -1;
z - fracția molară a produsului dorit în amestecul gazos;
S - viteza spațială, h-1;
ρ - densitatea de reactiv, în condiții normale, kg / m3.
otrăvirea catalizatorului - o pierdere parțială a activității, ca urmare a unei cantități mici de substanțe cunoscute ca otrăvuri contact. Aceasta este cauzată de interacțiunea chimică cu otrava de catalizator cu formarea compușilor catalitica inactivi.
Otrăvirii pot fi reversibile și ireversibile. Când otrăvire reversibilă a activității catalizatorului scade numai în timpul prezenței otrăvii în amestecul de intrare. La internare amestec pur cu catalizatorul de compuși poison sunt descompuse, otravă adsorbit volatilizate și distilă împreună cu produșii de reacție.
otravire ireversibila este permanentă. Otrăvit catalizatorul trebuie să fie înlocuit cu un nou sau regenerate vechi. Cele mai sensibile la catalizatori otrăvurile din metal, în special metale nobile. Pentru catalizatorul de platină utilizat în procesele de oxidare sunt otrăvuri H2 S, compuși arsen, ioni metalici Pb + 2. Cu ++. Sn +. Fe +. Prin poison catalizatori de hidrogenare includ H2 S, PH3. NH3. O2.
Activitatea catalizatorului poate scădea în timpul sinterizării (scăderi de suprafață), depunerea de impurități pe suprafața lor, cum ar fi cocs.