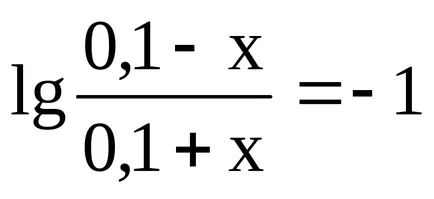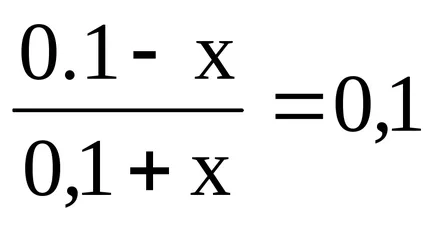Calcularea tampoane pH 1
Calculați pH-ul soluției tampon conținând în 1 I de acid acetic 0,1 M și 0,1 moli de acetat de sodiu.
Concentrația ionilor de hidrogen este calculat din constanta de disociere a acidului acetic:
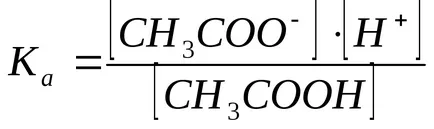
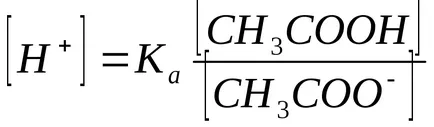
În prezență de acetat de sodiu acetat de disociere la echilibru deplasat spre stânga, deci putem presupune că
În general, pentru o soluție tampon formată prin amestecarea unui acid slab și sarea sa:
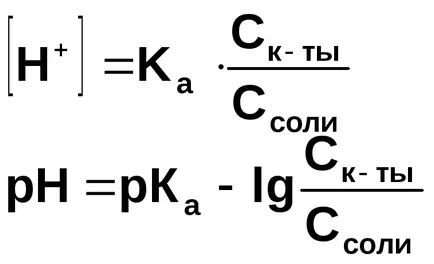
Calculați pH-ul soluției tampon conținând în 1 litru de 0,01 mol de hidroxid de amoniu și 0,1 mol de clorură de amoniu.
Concentrația de ioni de hidroxid calculat din constanta de disociere de hidroxid de amoniu:
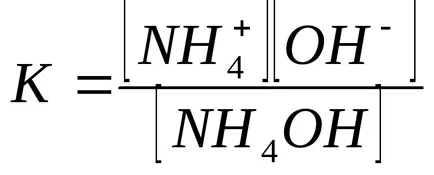
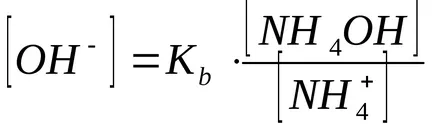
În prezența clorurii de amoniu, hidroxid de disociere la echilibru este deplasat spre stânga, deci putem presupune că
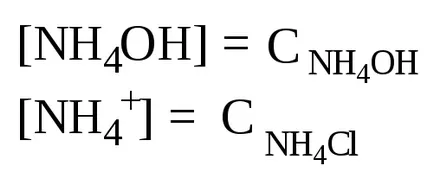
Pornind de la produsul ionic al apei, se calculează [H +] și pH-ul soluției:
În general, pentru soluțiile de tamponare formate prin amestecarea unei baze slabe și sării sale:
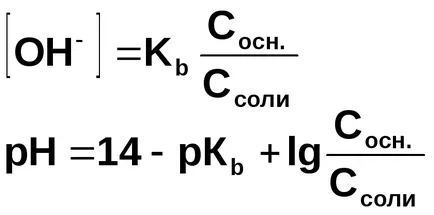
Mecanismul de acțiune a sistemelor tampon
Acțiunea de tamponare se bazează pe componentele sistemului tampon de legare care vin în soluția de ioni H + și OH - ioni pentru a forma electroliții slabi.
Calculăm cum se schimba pH-ul soluției tampon de 1 litru cu concentrația de acid acetic și acetat de sodiu la 0,1 mol / l, adăugând la acestea: a) 0.01 molHCl; b) 0,01 molNaOH; c) la diluție de 10 ori.
a) Atunci când adăugat la soluția tampon de HCl în exces ioni H + vor lega anionul de acetat în molecula de acid acetic electrolit slab:
Concentrația de acid acetic molecular crește cu 0,01 moli / litru, iar concentrația ionilor acetat va scădea cu aceeași sumă:
[CH3COOH] = 0,1 + 0,01 = 0,11 mol / l
[CH3 COO -] = 0,1 - 0,01 = 0,09 mol / l
pH = = -5 2,1410-LG 4,67
Astfel, pH-ul soluției tampon a scăzut 4.76-4.67, adică, 0,09. (Pentru comparație, adăugând 0,01 mol de HCI la 1 litru de apă pH între 7 și la 2, adică 5 unități).
b) La adăugarea de NaOH la soluția tampon, ionii in exces OH - va interacționa cu moleculele de acid acetic pentru a forma un electrolit de apă slab:
Concentrația de acid acetic molecular este redusă la 0,01 mol / l și concentrația ionilor acetat va crește cu aceeași sumă:
[CH3COOH] = 0,1 - 0,01 = 0,09 mol / l
[CH3 COO -] = 0,1 + 0,01 = 0,11 mol / l
pH = = -5 1,4310-LG 4,84
Astfel, după adăugarea alcaline modificări pH-ul numai ușor (cu 0,08).
c) La un tampon de diluare într-o concentrație de 10 ori mai mare a componentelor sale sunt de asemenea reduse de 10 ori, iar în cazul în care nu au fost luate în considerare modificările survenite în gradul de disociere a acidului acetic la un pH soluție de diluare nu se schimbă:
pH = = -5 1,7510-LG 4,76.
Capacitatea de a tampona sisteme pentru a menține constanța pH-ului soluției tampon este definit, și capacitatea soluției limitate.
Capacitatea de tampon este egal cu numărul de echivalenți de acid sau alcalin, prin adăugarea unui pH-ului soluției este schimbat de unul.
Capacitatea de tampon este dependentă de concentrația componentelor tampon și relațiile lor. Aceasta crește odată cu creșterea concentrației soluției și atinge o valoare maximă la o concentrație egală a componentelor sale.
Fiecare sistem tampon are un domeniu de funcționare de pH, dincolo de care capacitatea de tampon scade brusc. La o soluție tampon formată din acid slab și sarea sa, domeniul de pH de lucru este la pKa 1.
Exemplu. Se calculează vasul tampon în raport cu soluția de acid care conține în 1 litru de hidroxid de amoniu 0,1 M și 0,1 mol de clorură de amoniu.
pH-ul soluției de alimentare se calculează ca:
Lăsați capacitatea de tamponare a acidului soluție prin x. Astfel x - este numărul de moli de acid care trebuie adăugată la soluția la un pH scăzut la unu, adică, A fost egal cu 8,26.
Când a adăugat la x moli de HCI are loc reacția soluție:
Astfel, concentrația de NH4OH este redus la (0,1 - x), și NH4 + crește concentrația până la (0,1 + x). Substituind aceste expresii în formulă pentru a calcula pH-ul soluției, obținem: