acid sulfuric
Acid sulfuric net 100% (monohidrat) este un lichid uleios incolor, se solidifică într-o masă cristalină la +10 ° C Acid sulfuric reactiv are o densitate de obicei 1,84 g / cm3, și conține aproximativ 95% SO4 H2. Se întărește doar sub -20 ° C
Punct de topire monohidrat este de 10,37 ° C la căldura de topire de 10,5 kJ / mol. În condiții normale, este un lichid foarte vâscos, cu o constantă dielectrică foarte ridicată (e = 100 la 25 ° C). Minor monohidrat sit electrolitic de disociere continuă în paralel în două moduri: [H3 + SO4] · [NSO4 -] = 2 x 10 -4 și [H3 O +] · [NS2 O7 -] = 4 × 10 -5. Compoziția sa ion molecular poate fi descrisă aproximativ prin următoarele date (în%):
0,18 0,14 0,09 99,5 0,05 0,04
La adăugarea chiar și cantități mici de apă devine schema de disociere dominantă: H2O + H2 SO4 <==> H 3 O + + NSO4 -
H2 SO4 - diacid puternic.
Primul pas (pentru concentrația medie) conduce la 100% disociere:
1) Reacția cu metale:
a) acid sulfuric diluat se dizolvă numai metale în picioare în seria electrochimică stânga hidrogenului:
b) concentrat H2 SO4 6 - un agent oxidant puternic; prin reacția cu metale (cu excepția Au, Pt) poate fi redusă la S 4 O2. S 0 sau H2 S -2 (fără încălzire și nici nu reacționează Fe, Al, Cr - pasivizat)
2) concentrat H2 S +6 O4 este reacționat cu încălzire cu unele nemetale, datorită proprietăților sale oxidante puternice, transformându-se într-un compus de sulf de stare de oxidare inferior (de exemplu, S 4 O2):
3) cu oxizi de bază:
CuO + 2H + -> Cu 2+ + H2O
2H + + Cu (OH) 2 -> Cu 2+ + 2H 2 O
5) reacții de schimb cu săruri:
Formarea de precipitat alb BaSO4 (insolubilă în acid) utilizat pentru identificarea acidului sulfuric și sulfați solubili.
Monohidrat (100% acid sulfuric pur) este un solvent ionizant având caracter acid. În ea sunt ușor sulfaților solubili ai multor metale (trecând astfel în bisulfat), în timp ce celelalte săruri acide sunt dizolvate, de obicei, numai dacă este posibil, solvoliza lor (cu conversie la bisulfat). Acidul azotic se comportă ca un osnovanieHNO3 slab monohidrat + 2 H2 SO4 <==> H3 O + + NO2 + + 2 HSO4 - albire - ambele foarte slab kislotaH2 SO4 + HClO4 = H3 + SO4 + ClO4 - acidul fluorsulfonic și clorsulfonic sunt oarecum mai puternice (HSO3 F> HSO3 Cl> HClO4). Monohidrat se dizolvă ușor de multe substanțe organice cu atomi în structura sa cu perechi de electroni neîmpărtășite (proton capabil de îmbinare). Unele dintre ele pot fi alocate înapoi la starea nemodificată prin simpla diluare a soluției cu apă. Monohidrat are o valoare ridicată constante cryoscopic (6,12 °), și folosesc uneori ca mediu pentru determinarea greutății moleculare.
Concentrat H2 SO4 este agent oxidant foarte puternic, mai ales atunci când este încălzit (în general, SO2 restaurat). De exemplu, se oxidează parțial (HCl, dar nu) HBr și HI la halogeni. Oxida-l și multe metale - Cu, Hg, etc. (în timp ce aurul și platina cu privire la H2 SO4 rezistent) .. Deoarece interacțiunea cu cupru provine din ecuația:
Acționând ca oxidant, de obicei acid sulfuric se reduce la SO2. Cu toate acestea, cel mai puternic de reducere poate fi redus la S și H2 S. Deoarece chiar și hidrogen sulfurat acid sulfuric concentrat reacționează conform ecuației:
Trebuie remarcat faptul că aceasta este, de asemenea, recuperarea parțial hidrogen gazos și, prin urmare, nu poate fi utilizată pentru uscarea acestuia.
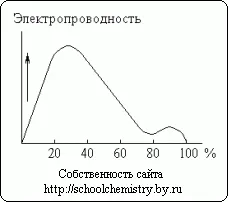
Fig. 13. Conductivitatea electrică a soluțiilor de acid sulfuric.
Dizolvarea acid sulfuric concentrat în apă este însoțită de evoluția considerabilă de căldură (și o scădere oarecare a volumului total al sistemului). Monohidrat cu greu conduce curentul electric. În contrast, soluțiile apoase de acid sulfuric sunt bune conductoare. După cum se vede în Fig. 13, conductivitate maximă are aproximativ un acid 30%. Curba minimă corespunde compoziției hidrat H2 SO4 · H2O
Se încălzește la dizolvarea monohidratului în cantități de apă la (în funcție de concentrația finală a soluției) la 84 kJ / mol H2 SO4. Dimpotrivă, prin amestecarea acidului sulfuric 66%, prerăcită la 0 ° C, și zăpadă (1: 1 în greutate) poate fi realizată prin scăderea temperaturii la -37 ° C,
(.% Din greutate) Modificarea densității soluțiilor apoase de H2 SO4 cu concentrația sa este prezentată mai jos:
După cum se poate observa din aceste date, determinarea densității concentrației acidului sulfuric peste 90 gr. % Devine foarte inexacte. Presiune vapori de apă peste soluțiile H2 SO4 de diferite concentrații la diferite temperaturi este prezentată în Fig. 15. Uscătorul ca acid sulfuric poate acționa numai atâta timp cât presiunea vaporilor de apă peste soluția este mai mică decât presiunea parțială în gazul uscat.
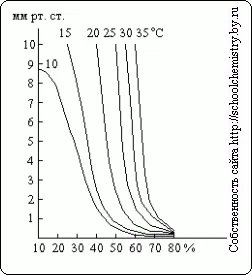
Fig. 15. Aburul de presiune.
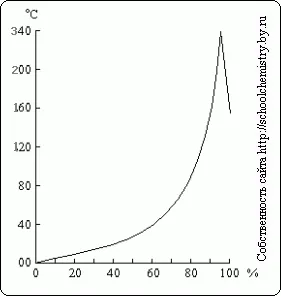
Fig. 16. Punctele de fierbere ale soluțiilor de H2 SO4. soluții de H2 SO4.
Când fierbe o soluție diluată de acid sulfuric din acestea apă distilată, cu temperatura de fierbere se ridică până la 337 ° C, când începe să distileze 98,3% H2 SO4 (Fig. 16). Dimpotrivă, din soluții mai concentrate se evapora excesul de trioxid de sulf. Aburul de fierbere la acid sulfuric 337 ° C, este parțial disociat în H2O și SO3. care din nou sunt conectate cu răcire. Punct de fierbere ridicat de acid sulfuric permite utilizarea pentru separarea prin încălzirea acizilor volatili din sărurile lor (de exemplu, HCl de NaCI).
Monohidratul poate fi preparat prin cristalizarea acidului sulfuric concentrat la -10 ° C,
Acid sulfuric.
Prima etapă. pirita cuptor.
1) măcinarea piritelor de fier (pirita)
2) Metoda „pat fluidizat“
3) 800 ° C; îndepărtarea excesului de căldură
4) crește concentrația de oxigen din aer
Etapa 2. După purificare, uscare și gaz sulfuros căldură intră în unitatea de contact în care oxidat la trioxid de sulf (450 ° C - 500 ° C; V2 catalizator O5):
Etapa a treia. turn de absorbție:
Apa nu poate fi utilizat datorită formării de ceață. Aplicați duza ceramică și un principiu contracurent.
Amintiți-vă! Acidul sulfuric este necesar să se toarne apă în porțiuni mici, și nu invers. În caz contrar, reacția chimică violentă poate să apară ca rezultat al care o persoană poate obține arsuri grave.
Acid sulfuric - una dintre principalele produse ale industriei chimice. Este folosit pentru a produce îngrășăminte (superfosfat, sulfat de amoniu), diverși acizi și săruri, medicamente și detergenți, coloranți, fibre sintetice și explozivi. Utilizat în metalurgie (minereuri desc, de ex. Uraniu) pentru curățarea uleiului etc. ca desicant.
Practic important este faptul că (mai mare de 75%) de acid sulfuric foarte puternic are nici un efect asupra fierului. Acest lucru face posibil pentru a stoca și a le transporta in rezervoare de otel. In contrast, se diluează H2 SO4 dizolvă ușor de fier cu hidrogen. Oxidantă proprietăți pentru că nu este caracteristic.
Acid sulfuric puternic absoarbe umezeala viguros și, prin urmare, sunt adesea folosite pentru gazele de uscare. Din multe substanțe organice care conțin în compoziția sa, hidrogen și oxigen, este nevoie de apa care este adesea utilizată în domeniu. C cu aceeași (precum și proprietățile oxidante puternice H2 SO4) este asociat efectul distructiv asupra țesuturilor vegetale și animale. Accidental lovit în timpul funcționării pe acid sulfuric cu pielea sau hainele ar trebui să fie imediat cu multă apă, apoi umeziți zona afectată cu o soluție diluată de amoniac și din nou cu apă.
Molecule de acid sulfuric pur.
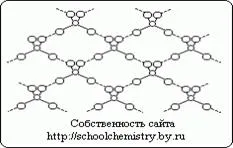
Fig.1. Schema de legături de hidrogen în H2 SO4 cristal.
Moleculele formează monohidrat cristalină, (HO) 2 SO 2 conectate între ele destul de puternic (25 kJ / mol) de legături de hidrogen, așa cum este prezentat schematic în Fig. 1. molecula în sine (HO) 2 SO 2 are o structură tetraedrică distorsionată cu un atom de sulf în apropierea centrului și se caracterizează prin următorii parametri: (d (S-OH) = 154 pm, RNO-S-OH = 104 °, d (S = O) = 143 nM, ROSO = 119 ° în HOSO3 ion - .. d (S-OH) = 161, și d (SO) = 145 pm, iar la trecerea spre SO4 ion 2- tetraedru capătă forma corectă și parametrii aliniata [d (SO) = 148 nM acid sulfuric] .Kristallogidraty.
Pentru acidul sulfuric sunt mai multe cristaline, a cărei compoziție este prezentată în Fig. 14. Dintre acestea, apa mai sărace reprezintă sare de oxoniu: H3 O + HSO4 -. Deoarece sistemul în cauză este foarte predispus la subrăcire observat de fapt, acestea sunt temperaturi de îngheț la temperaturi de topire mult mai mici.
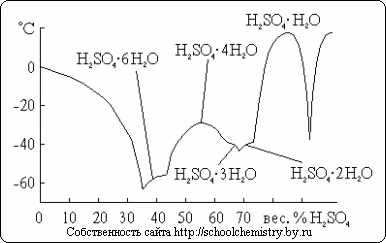
Fig. 14. Temperaturile de topire în sistem H2O · H2 SO4.