Tranzițiile între statele agregate - studopediya
Este important să se cunoască și să înțeleagă modul în care tranzițiile între starea fizică a materiei. Schema de astfel de tranziții reprezentată în figura 4.

2 - solidificare (cristalizare);
3 - evaporare: evaporare sau fierbere;
5 - sublimare (sublimare) - trecerea de la solid la starea gazoasă, ocolind lichidul;
6 - sublimare - trecerea de la gazoasă la starea solidă, ocolind lichidul.
B. 2 de topire și de congelare de apă cu gheață (cristalizare)
Dacă gheața este pus în balon și se începe încălzirea cu un arzător, se va observa că temperatura începe să crească până când ajunge la o temperatură de topire (0 ° C). Apoi, procesul de topire începe, dar nu va crește temperatura gheții, și numai după ce toate temperatura de topire de gheață a apei de proces format începe să crească.
Definiția. Topire - trecerea de la solid la lichid. Acest proces are loc la o temperatură constantă.
Temperatura la care materialul de topire și punctul de topire se numește o valoare măsurată pentru mai multe solide, și, prin urmare, valoarea tabelară. De exemplu, punctul de topire al gheții este de 0 ° C, iar punctul de topire a aurului 1100 o C.
Inversa procesul de topire - proces de cristalizare - este de asemenea convenabil să ia în considerare exemplul înghețării apei și transformarea acesteia în gheață. Dacă luăm tubul cu apă și să înceapă să se răcească, va fi mai întâi observat scăderea temperaturii apei, până când ajunge la 0 ° C, iar apoi congelare la o temperatură constantă) și după congelare completă a răcirii ulterioare a gheții formate.
Dacă aceste procese sunt luate în considerare în ceea ce privește energia internă a corpului, apoi pentru topirea toată energia produsă este consumată în corpul perturbării rețelei cristaline și slăbirea legăturilor intermoleculare, deci nici o energie este consumată la schimbările de temperatură și schimbările în structura materiei și interacțiunea particulelor sale. În procesul de schimb de cristalizare a energiei are loc în direcția opusă, organismul pierde căldură în mediul înconjurător, iar energia sa internă este redusă, reducând astfel mobilitatea particulelor, creșterea interacțiunii dintre ele și corpul solidificat.
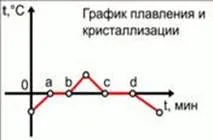
Este util să se poată descrie grafic substanța proceselor de topire și cristalizare pe grafic. Situat pe axele graficului: axa x - timpul, axa y - temperatura substanței. Deoarece substanța de testat va lua gheață la o temperatură negativă, t. E. O astfel că atunci când căldura este preluat imediat începe să se topească, dar va fi încălzit la temperatura de topire. Vom descrie porțiuni din diagramă care reprezintă procese termice individuale:
Starea inițială - a: încălzire pe gheață la temperatura de topire de la 0 ° C;
a - b: un proces de topire la o temperatură constantă de la 0 ° C;
b - cu unele punct de temperatură: încălzirea gheața formată din apă la o anumită temperatură;
Punct la o anumită temperatură - c: apă de răcire la temperatura de congelare de la 0 ° C;
c - d: înghețarea apei de proces la o temperatură constantă de la 0 ° C;
d - starea finală: răcire cu gheață până la o anumită temperatură negativă.