sistem omogen
sistem omogen (de la homo. U. Gene) sistem termodinamic, toate acestea fiind caracteristici (de exemplu compoziție chimică, densitate, presiune) sunt constante sau în continuă schimbare în spațiu. amestec de gaz Omogen pot fi soluții lichide sau solide și alte sisteme. O distincție este spațial omogen și sistem eterogen, omogen. Într-un sistem omogen proprietăți omogene în diferite părți ale sistemului sunt aceleași, în eterogen - diferit. Exemple de sisteme spațial neomogene omogene: gaze, lichide, amestecuri de gaze, soluții într-un câmp exterior, cu condiția ca, în absența câmpului sunt spațial omogene. Cu toate acestea, ca urmare a schimbării continue în proprietățile unui sistem omogen neomogene, în contrast cu sistemul eterogen, nici o parte a secțiunilor suprafețelor pe care cel puțin o proprietate se schimbă brusc. Omogen sistem cu o singură fază, dar poate fi multicomponente.
Cataliza Omogen, crește viteza reacțiilor chimice în gazul sau faza lichidă, prin acțiunea catalizatorilor sunt în aceeași fază ca reactanți. Heterofazic reacție CO + H2O → ← CO2 + H2 poate fi, de asemenea, o reacție catalitică omogenă, deoarece volumul catalizatorului are loc în soluție (de exemplu, Rhl3) cu CO dizolvat.
Caracteristicile proceselor catalizate omogen. Principalele caracteristici ale procedeului sunt cantități catalitice omogene de activitate catalitică și selectivitatea reacției catalizate. Selectivitatea poate fi reprezentat prin proporția de materii prime au reacționat convertit în produsul dorit, ținând cont de stoechiometria reacției. Pentru exprimarea activității catalitice este utilizată sau un raport fix al ratei inițiale de reacție la concentrația molară a formei active a catalizatorului - așa-numita viteză (sau frecvența) a catalizatorului de revoluții (indicat TOF, din limba engleză cifrã de frecvență). În practică, de multe ori utilizarea asociată cu TOF, dar nu sunt identice la aceasta cantitate - raportul dintre cantitatea molară totală a produsului de reacție la cantitatea molară totală a catalizatorului și timpul de reacție, care este, de asemenea, numit TOF. Activitatea caracteristică vizuală și stabilitatea catalizatorului este numărul de rotații ale catalizatorului (număr TON, cifrã), egal cu numărul de cicluri catalitice în termeni de 1 mol de catalizator (exprimat ca raportul dintre cantitatea molară a unui produs de reacție la cantitatea molară de catalizator).
Clasificarea proceselor catalitice omogene și mecanisme. .. În funcție de natura catalizatorului, adică, capacitatea specifică pentru interacțiunea cu substratul, procese catalitice omogene sunt împărțite în următoarele tipuri: o cataliză cu acid-baza de acizi protici sau baze Johannes Nicolaus Bronsted electrofil (implicând acizi Lewis aprotici) și nucleofil (cu baze Lewis) Catalysis, compuși cataliza metal-metal complex, cataliza compușilor organici sintetici, și cataliză enzimatică.
cataliză acidă - substraturi de activare având perechi de electroni liberi, acizi protonici (vezi Acizii și bazele) - apare ca rezultat al unui adaos de acid proton pe substratul. Protonarea substratului în soluțiile apoase acide este în mod tipic reacția de substituție a apei în hidratată cationi H (H2O) + n substrat molecula. specii active de intermediari în cataliză acidă servesc adesea carbeniu ioni R +. care este aceeași ca și protonul moleculele solvaților H2O, solvenții organici sau acizi puternici, de exemplu, R (H2O) +. (C2 H5) 3 O +. RH2 SO + 4. Cataliza de bază - activare bazelor Johannes Nicolaus Bronsted - este rezultatul clivajului unui proton dintr-un substrat de bază pentru a forma molecula de substrat a particulelor anionice este nucleofil foarte puternic. Astfel, hidratarea alchenelor în prezența acizilor minerali puternici - reacția tipică catalizată acid - poate fi reprezentat ca o succesiune de etape:
condensarea aldolică acetonă în prezența alcaliilor - exemplu cataliză bazică - în forma:
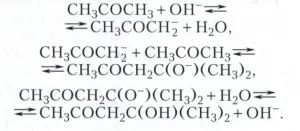
Foarte puternic acid protic (superacid) capabil face favoruri oficiale compus care nu are perechi de electroni liberi, cum ar fi alcani, pentru a forma un ion carboniu RH + 2 (CH + 5, etc.). ioni de carbon sunt implicate în reacțiile de alchilare, cracarea și izomerizarea alcanilor.
Electrofile Cataliza - activare electrofil acid Lewis aprotic - este însoțită de o scădere a densității de electroni pe centrul de reacție substrat (bază Lewis), până la formarea unui ion de carbeniu. Printr-o astfel de mecanism are loc, în special, alchilarea compușilor aromatici; de exemplu, alchilarea benzenului cu schema de bromură de alchil C6 H6 + RBr → C6 H5 R + HBr cuprinde formarea unui complex reactiv R + [Al2 Br7] - ca rezultat al interacțiunii cu catalizator bromură de alchil Al2 BR6 și acțiunea carbeniu cation R + pe molecula de benzen.
In reacțiile de molecule care conțin halogen (.. CBr4 RCOCI, SO2 Cl2 etc.) sau cu Al2 VR6 Al2 SL6 apar particule superelektrofilnye (de exemplu, CBr 3 Al2 + Br - 7). Superelectrophiles cataliza cracării alcanilor în condiții blânde.
Protici și catalizatori aprotici (electrofile) accelera procesele de alchilare, acilare, sinteza diene și chiar unele reacții redox. De exemplu, acizii protici catalizează oxidarea isopropanol la trifenilkarbinolom acetonă prin etapa trifenilmetil formarea de cationi (C6 H5) 3 C +. Acizii aprotici (alkoxizilor aluminiu) - reducerea cetonelor cu alcooli (Meerwein - Ponndorfa - reacția Verley) și disproporționarea aldehidelor (reacția Tishchenko) prin formarea unui complex între alcoxidul Al și compus carbonil.
Cataliza nucleofil baze Lewis are loc pentru a forma un catalizator intermediar aduct nucleofilă la un substrat (de exemplu, bromurarea electrofilă alchenelor în prezența ionilor de halogenură), sau pentru a forma o produse de substituție intermediare (de exemplu, substituția la atomul C saturat este hidroliza halogenuri de alchil în prezența anionului I - - catalizator nucleofil activ și grupa apoi ușor deplasabilă).
Când compuși organici cataliza cu catalizatori de funcții sunt în general mai complexe decât electrofili sau nucleofili. Exemple de acest tip de cataliză omogenă - autocataliză glicol aldehidă formaldehidei condensare până în zaharuri medii de bază (reacția Butlerova), descompunerea radicalilor peroxidici catalizate n-benzochinonă conform schemei
cataliză aminoacizi (prolină) condensarea aldolică, reacția Mannich, și alte procese.
In cele mai multe procese de cataliză prin complecși metalici se realizează prin intermediari metalici-intermediari, inclusiv într-un tipic procese redox implicând reactivi anorganici. De exemplu, complexele din cataliza Mo (III) reducerea azotului molecular cu schema de amalgam de sodiu N2 + 4Na + 4H2O → NH2 NH2 + 4NaOH N2 care rezultă din interacțiunea cu Mo (III) complex [Mo 4+-N = N-Mo 4+ ] acţiunea Na atunci când sunt convertite în anionul [Mo 4+ = N-N = Mo 4+] 2-; reacția acestei particule intermediare cu H2O și conduce la formarea de hidrazină (reacție deschis colaboratorii A. E. Shilovym). Doar un număr mic de reacții de transfer de electroni catalizate de complecși metalici, intermediari tipici derivate fără a forma transferului de electroni exterior sferă.
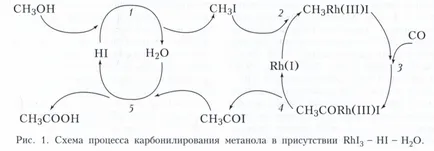
Cel mai frecvent tip de complex metalic cataliză omogenă - reacții de cataliza ale compușilor organici cu formarea intermediarilor organometalici cu legături de metal-carbon, așa-numita cataliza organometalici. Tipic pas cataliză organometalic este ilustrată de cele două procese. Originea - producția industrială de acid acetic prin carbonilarea de metanol în sistemul catalitic RhI3 - HI - H2O Sarea Rh (III) este un precursor al catalizatorului activ - Rh complex (I), format prin reacția RhI3 + 3SO + H2O - Rh (CO) 2 I - 2 + CO 2 + HI + H +. Mecanismul procesului poate fi reprezentat printr-o secvență ciclică a etapelor (Fig. 1). Etapa 1 - substituția cu halogen la gruparea hidroxil, etapa 2 - CH3I oxidativ plus Rh (I), Etapa 3 - introducerea CO CH3 comunicare -Rh, etapa 4 - eliminarea reductivă atsiliodida CH3 COI, etapa 5 - substituția nucleofilă I - o apa atsiliodide. In acest proces, cu excepția Rh complex (I), un catalizator de acid protic participă la HI două cicluri catalitice. Astfel de sisteme sunt denumite sisteme catalitice ca multifuncționale.
Al doilea exemplu - alchinelor hidratare implicând trei catalizatori: complecși de Cu (I) (cataliză complex), tiol RSH (cataliză nucleofilă) și HCI (cataliză acid protic) care curge împotriva regulii Markovnikov (figura 2). Etapa 1 - formarea π-complex, etapa 2 - nucleofil plus RSH la tt-complex, Etapa 3 - substituția electrofilă Cu (I) un proton, etapa 4 - adăugarea electrofilă de H + (protonare tiopropenilovogo eter), etapa 5 - substituția nucleofilă apă tiol .
Complexul metalic Cataliza izolat cataliză asimetrică utilizând catalizatori complecși metalici chirali care permit să efectueze reacții stereoselective (a se vedea articolul în sinteză asimetrică). De exemplu, în industria Rh complexelor (I) cu liganzi fosfinici chirali dihidroxifenilalanină preparat (un medicament pentru tratamentul bolii Parkinson).

problemă tehnică importantă prin cataliză - separarea catalizatorului din produsele și recircularea catalizatorului - se realizează în detrimentul imobilizare a complecșilor metalici folosind liganzi pe suprafața suport sau într-una dintre faze folosind sisteme cu două faze (de exemplu faza organică și apă în care se dizolvă un complex metalic); utilizarea sărurilor organice topite (lichide ionice), în care un complex metalic este imobilizată aplicând membrane de ultrafiltrare pentru a separa produsele și ispol'uet mations termomorfnyh liganzi sau solvent, schimbarea temperaturii în funcție de starea de fază.
Aplicație practică. Printre cel mai important proces catalizat omogen industrial (cu excepția numit mai sus) includ sinteza cu CO, oligomerizarea etilenei cu cross-metateza terminale și alchenelor interne, dimerizarea etilenei și propilenei, hidrogenarea funcțional de alchene substituite, compușii nitro, epoxidarea propilenei, oxidarea compușilor alchilaromatici, etc. . Multe procese de metal catalitic pentru activitatea catalizatorului, chemo-, regio- și stereoselectivitate abordării enzimatice. Folosind modelele structurale și funcționale ale enzimelor, principii biochimice ale proceselor poate crea un metal eficient procesele de cataliza complexe (vezi reacția Biomimetic).