Și măsurarea temperaturii sale
Când echilibrul termic 2-corp:
- nu există nici un schimb și de fază de tranziție de căldură
- y 2 corpuri aceeași temperatură și energia cinetică a moleculelor
- Aceasta nu schimbă presiunea și volumul.
Temperatura - cantitatea fizică care descriu starea de echilibru termodinamic, care caracterizează intensitatea mișcării aleatoare a moleculelor.
Măsurarea temperaturii se produce prin termometre.
Termometru - un dispozitiv în care un volum de gaz sau lichid, depinde de temperatura.
Termometre sunt gaz și lichid (mercur și alcool).
Termometre sunt întotdeauna aduse în contact cu corpul de măsurare înainte de echilibru termic.
Temperatura - descrierea întregului corp, nu o singură moleculă.

Bilet №8. Ecuația Mendeleev-Clapeyron. Clapeyron. Izoprotsessy în gaze.
Această ecuație descrie starea unui sistem termodinamic.
Ecuația se referă la macroparameters unui anumit gaz (presiune. Volum și temperatură) la masa sa.
P - Presiune (Pa) V - volumul () T - temperatura absolută (K) m - Greutate (kg) # 120641; - masa molară (kg / mol)
# 120642; - cantitatea de substanță (mol) R - este gazul universal constantă R = 8,31 J / Molkov
Această ecuație descrie starea unui sistem termodinamic cu o masă constantă de gaz.
Ecuația se referă la macroparameters unui anumit gaz (presiune. Volum și temperatură) greutate constantă.
- Presiune (Pa) - Volum () - temperatura absolută (K) - nachalnomsostoyanii gaz
- Presiune (Pa) - Volum () - temperatura absolută (K) - în starea finală a gazului
=
Izoprotsessy în gaze.
Izoprotsess - un proces în care unul dintre parametrii macroscopice ale stării unui masă dată de gaz rămâne constantă.
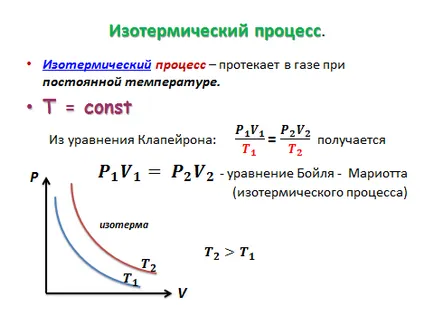


Bilet № 9. Evaporarea și condensare. Saturate și nesaturate pereche. Umiditatea relativă a aerului și măsurarea acestuia.
Spre deosebire de un gaz ideal, gazul real nu este complet se supune legii lui Boyle: prima compresie crește presiunea, iar apoi se lichefiază la o presiune constantă, atunci volumul nu este redus.
Evaporarea - trecerea moleculelor unui lichid într-o stare gazoasă. Aceasta are loc cu absorbție de energie.
Condensarea - porțiunea de tranziție a moleculelor de gaz în volumul de lichid. Aceasta are loc cu eliberarea de energie.
Dinamic echilibru - o stare în care numărul egal cu numărul de molecule evaporate prokondensirovavshih.
abur saturat - este în echilibru dinamic cu lichidul său. Presiunea de vapori saturați depinde numai de temperatura. lichid exemplu- într-un recipient închis.
perechi nesaturati - sub presiune sub presiunea vaporilor saturați. Exemplu - lichid într-un vas deschis.
Fierberea - evaporarea volumului de lichid. Fierbere începe numai atunci când presiunea din bula de gaz devine egal cu atmosferică.
Punctul de fierbere depinde de presiunea mediului ambiant. Cu o presiune tot mai mare, punctul de fierbere crește și invers.
umiditate - absolută și relativă.
Umiditatea - numărul de vapori de apă în 1 m3 de aer. (Presiunea I.E., parțială).
Umiditatea relativă - raportul dintre presiunea parțială a presiunii de vapori saturați, exprimată în procente.
P - Presiune (Pa) Ph parțial - saturat la presiunea vaporilor (Pa) - Umiditate relativă (%)
Presiunea parțială - partea de presiune a gazului prezent în amestecul de gaz.
Umiditatea relativă este măsurată prin higrometre și psihrometre.
Psihrometru - păr, în legătură cu o săgeată, care se schimbă lungimea sa, în funcție de umiditatea.
Higrometru - două termometre, una măsoară temperatura aerului uscat și umezit altele. Prin diferența dintre termometre uscate și umede și tabelul psychrometrica definesc umiditatea relativă.