Reglementarea activității enzimei
reglementarea alosteric însoțită de schimbări în afinitatea enzimei la substrat fără a modifica rata maximă de reacție. Acest lucru este foarte comună și reglementarea sensibilă.
reprezentate pe scară largă, cum ar fi coenzime AMP, ADP, ATP, NAD, NADH, NADP, NADPH, acidul citric, acetil-koa și multe altele, care sunt ambele substraturi, produse și regulatori de reacții enzimatice.
Reglementarea activității enzimei apare ca o modificare covalentă. Deschiderea acestui traseu - cea mai importantă realizare de Biochimie. Activarea și inhibarea activității enzimei prin fosforilarea kinaze implicate în ATP procese ciclice de acțiune hormonală, prezența hormonilor in membranele celulare ale receptorilor specifici - toate acestea este o nouă etapă în studiul reglarea metabolismului.
Schema generală a regulamentului în acest caz, sunt după cum urmează: AMP ciclic (cAMP) este conectat la o subunitate de reglementare, ceea ce conduce la eliberarea subunitățile sale active catalitic, adică concentrația de cAMP, formarea sa este influențată ciclaza și divizarea sub influența fosfodiesterazei stau la baza reglementarea unui număr de căi metabolice. Fosforilarea este, de asemenea, o activitate enzimatică metabolică mecanism comun de reglementare.
reglementarea Hormonal a activității enzimei constă în faptul că există o legătură între efectul hormonilor asupra proceselor de transcripție și modificarea proteinelor de bază non-histonice. Hormonii pot acționa ca efectori (site-uri senzoriale) ADN etc.
reglarea nervoasă a activității enzimelor studiate pentru o lungă perioadă de timp (metabolism). Animalele cu transection nerv dovedit că în timp ce un număr de enzime în țesutul muscular schimbă proprietățile sale.
Mecanismul de acțiune al enzimelor
Probleme cu structura si functia enzimelor, problemele mecanismul lor de acțiune fac obiectul laboratoarelor de conducere din lume. Creșterea vitezei de reacție enzimatică atribuită faptului că cataliza enzimatică a unei enzime este cuplat (în principiu reversibil) cu substratul său pentru a forma instabil complex fermentsubstratny intermediar care se descompune, la sfârșitul reacției eliberarea produselor enzimatice și de reacție (Arnie Michaelis Menten 1910 1915.). Michaelis nu numai postulată formarea unui substrat-enzimă intermediar ES-complex, dar influența calculată a concentrației substratului asupra vitezei de reacție.
În timpul reacției, sunt următorii pași:
1. Aderarea la molecula de substrat pentru enzimă.
2. Conversia compușilor intermediari primari în unul sau mai mulți complecși consecutive (tranzitorii).
3. clasificatorului produselor finale de reacție din enzimă.
Vreaktsiyah anabolism, admisibil + B AB, enzima poate fi cuplat atât unul cu altul și cu substratul sau ambele substraturi:
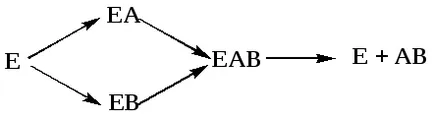
Vreaktsiyah catabolism, de exemplu: ABA + B
b) ABEA BE + (a + b + c) EA + AB + VE
Schema formează un complex enzimatic substrat intermediar este reprezentat în figura 4.2. Dacă centrul activ al enzimei conține o coenzimă, un complex ternar format (Figura 4.2.).
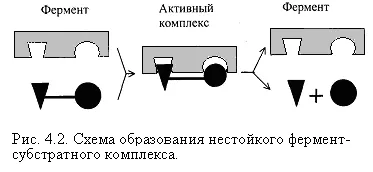
Enzima reacționează cu substratul pentru o perioadă foarte scurtă. Existența unui astfel de complex pentru a obține probe numai în ultimii ani. În formarea complexului enzimă-substrat care implică legături de hidrogen, interacțiuni electrostatice și hidrofobe, precum și, în unele cazuri, coordinare covalente. Informații despre natura relațiilor pot fi obținute prin electronica de spin rezonanță (RES), rezonanță magnetică nucleară (RMN), infraroșu și spectroscopie în ultraviolet. Pentru activitatea catalitică este structura spațială esențială a proteinei enzimei în care porțiuni din spirale oc rigid intercalate cu segmente flexibile, elastice liniare care furnizează schimbări dinamice ale moleculei de proteină enzimă. În procesul catalitic sunt corespondență esențială între enzimă și substrat, precum și avantajele termodinamice și catalitice ale unei astfel de conformitate. Aceasta înseamnă că între enzimă și substrat trebuie să fie nu numai complementaritatea spațială sau geometrică, ci și electrostatice - împerecherea sarcini opuse (e) de substrat și enzimă centru activ.
Astfel, în mecanismul de rol principal al enzimei cataliză este jucat de complexele de substrat de enzima intermediare, a căror formare este determinată de structura fină a centrilor activi și efectorul și structura unică a moleculelor enzimatice întregi care asigură o activitate catalitică ridicată și specificitatea acțiunii biocatalizatori.
Cinetica reacțiilor enzimatice în funcție de natura reactanților - enzima, substratul și condițiile lor de interacțiune - concentrație, pH, temperatură, prezența activatori sau inhibitori.