receptorii nucleari
Receptorii nucleari și liganzii lor
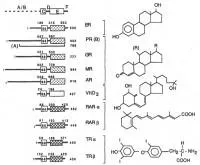
receptori ai hormonului steroid (estrogen, progesteron, androgen, glucocorticoizi, mineralocorticoizi, vitamina D, ecdysone), hormoni tiroidieni, retinoide si alte molecule receptor-like (orfane receptorilor așa-numitele), liganzi care nu sunt în prezent descrise complet (Figura ) .. Spre deosebire de receptorii hormonali peptidici localizate pe suprafața membranei plasmatice și care necesită un al doilea mesager pentru realizarea efectelor celulare, receptorii lor nucleare, după cum sugerează și numele, sunt localizate în nucleul celulei și dependentă de ligand actul mecanism cofactori (coactivators sau corepressors ) factori de transcripție reglează expresia genei cuprinde un promotor care este sensibil la acțiunea elementului regulator.
Majoritatea receptorilor nucleari Structura primară a fost stabilită prin secvențierea ADNcs corespunzătoare (vezi. Fig.). Deși sunt detectate diferențe în secvența de aminoacizi a moleculelor de proteine de receptor, începând cu aminoacizi 427 vitamină reziduu al receptorului D 984 la reziduu receptor al hormonului mineralocorticoid, caracteristicile generale comune tuturor organizarea structurală a receptorilor nucleari, care au determinat să le combine într-o singură familie. In structura receptorilor intracelulari prezent ADN dimensiune domeniu de legare a 66-68 de resturi de aminoacizi (C din fig.) Care prezintă un grad înalt de omologie cu alți membri ai familiei, precum și domeniul de legare a ligandului (E) de mărime variabilă și un grad scăzut de omologie, care determină specificitatea de legare a unui regulator de greutate moleculară scăzută. ADN-legare rest cuprinde două așa-numitul „deget de zinc» (figgers zinc) - structuri în formă de buclă formată din cisteină și glicină reziduuri, unite prin legături coordonate cu ioni de chelat de zinc. Rolul „deget de zinc“ este recunoașterea și legarea specifică a unui anumit element de genă de detectare, de obicei, în canelura principală a moleculei de ADN (Fig.).
Atunci când sunt expuse la celulele țintă hormon steroid (de exemplu, cortizol), în condiții in vivo sau in vitro au format două complexe diferite de receptor steroid. O fracție minoră a hormonului etichetat găsit în fracția de supernatant sau țesuturi omogenatul citosol, în timp ce majoritatea steroid încorporat asociat cu proteina din fracțiunea nucleară și este eliberată numai atunci când reextrage expunere. Este semnificativ faptul că asocierea complexului de receptori hormonali cu componentele fracțiunii nucleare (adică, ADN) este mai puternică decât receptorul liber.
Diferența esențială în legarea hormonului tiroidian și acid retinoic constă în distribuția complexului hormon receptor numai în fracțiunea nucleară, care este descris în detaliu mai târziu.
Studiile ulterioare au arătat în mod convingător că ligandul inductibile / receptor al hormonului de transformare inerentă a receptorilor nativi ai tuturor claselor de hormoni steroizi, dar nu hormoni tiroidieni. Transformarea receptorilor de estrogen este de asemenea însoțită de o creștere constantă de sedimentare, datorită dimerizarea receptorului. Deși transformarea receptorului nu este însoțită în mod necesar de dimerizare spontan stabilit ca receptorii de progestative, glucocorticoizi și hormoni tiroidieni interacționează cu secvențele ADN nuclee sensibile prezente în formă dimerizată. De asemenea, sa constatat că transformarea și dimerizarea receptorului hormonului steroid poate adesea să apară într-un ritm mai rapid după etapa de reducere a Ks. Acest fenomen a fost o explicație după descrierea interacțiunii cu proteinele receptorilor native de șoc termic - chaperon celule variante (proteine care promovează stabilizarea structurii ARNm 2 clorhidric și numărul de proteine și sunt sintetizate ca răspuns la prezentarea celulei de urgență stimuli). Este posibil ca chaperon'bi ocupă situsul de legare a receptorului cu secvența nucleotidică sensibilă și eliberați-l când transformați în condiții intracelulare neobișnuite (de exemplu, în prezența anionilor metalici endogene sau aminofosfoglitserola). Eliberarea situsuri de legare are loc atunci când reacția steroid cu centrul anionic sau prin activitate autoproteolytic inducerea proteinelor de șoc termic. Valoarea exactă a acestor interacțiuni rămâne necunoscută, deși se poate presupune acestea sunt amplificate și / sau rezolvarea rol.
Mai multe studii au arătat că receptorii hormonilor tiroidieni după sinteza lor sunt supuse translocația la nucleu si exista permanent sub forma ADN-legat (fără nici o legătură cu proteinele de șoc termic) și, prin urmare, nu sunt supuse transformării induse de ligand. De asemenea, sa constatat forma citosolic a hormonului tiroidian și receptorii acidului retinoic. Celulele au fost sensibile la efectele țesuturilor acidului retinoic conțin așa-numita proteina de legare celulară, CRABP, care poate servi ca purtător al hormonului citosolic.
Interpretarea modernă a teoriei activării în două etape a receptorilor hormonului steroid este discutarea problemei prezenței receptorilor citosolice și nevoia de transformare și translocația sale la nucleu. Majoritatea cercetătorilor au împărtășit opinia că valabilitatea activării în două etape a receptorului. Rămâne poziție controversată despre citoplasmatice-nuclear echilibrul de distribuție al receptorului însuși mecanismul translocare.
Receptorii nucleari și liganzii lor >>>>