răcire prin evaporare
În cazul în care lichidul se evaporă lăsând o moleculă, energia cinetică este mai mare decât energia lor cinetică medie. Prin urmare, valoarea medie a energiei cinetice a moleculelor rămase ale scăderilor lichide. Aceasta înseamnă scăderea temperaturii lichidului evaporat. De aceea te simți că devine rece imediat după înot într-o zi fierbinte de vară. Evaporarea apei din piele duce la răcirea. Este de asemenea cunoscut faptul că hainele ude mai reci decât uscate, mai ales în condiții de vânt. Foarte răcire puternică se obține dacă evaporarea are loc rapid. Odată cu evaporarea rapidă a eterului, la presiunea atmosferică, de răcire poate avea loc sub O ° C Este posibil să se detecteze cazul. Cele eyeglass concave au nevoie pentru a turna un pic de eter, și puneți-l pe masa înmuiată în apă. Odată cu evaporarea rapidă a eterului (accelera evaporarea prin suflarea de aer peste eter) bucată de sticlă ingheata la suprafața mesei. Răcire prin evaporarea lichidelor volatile utilizate de către medici atunci când trebuie să înghețe pielea pacientului, pentru a face insensibil la durere.
În țările calde pentru apa de răcire conțin, în general, în vasele sale de lut poroase. Apa curgând prin porii evapora recipient, apă de răcire în vas.
Dacă este imposibil să se evapore lichidul, răcirea va fi mult mai lent. Amintiți-vă cât de mult se răcește supa de grăsime. Stratul de grăsime de pe suprafața sa împiedică ieșirea moleculelor de apă rapide. Lichid aproape se evapora, iar temperatura scade (foarte grase se evapora foarte lent, deoarece moleculele sale mari sunt mai puternic legate unul de altul decât moleculele de apă), încet.
Prin evaporarea solidelor
Evapore nu numai lichide, ci și corpuri solide. Molecule care sunt situate la suprafață solidă și au suficientă energie cinetică în măsură să părăsească corpul. Procesul trecerii unei substanțe din starea solidă direct la un numit sublimare gazos sau sublimare.
De exemplu, naftalină sau camfor se evapore la temperatura camerei și presiunea atmosferică, ocolind stare lichidă. In mod similar, cristalele se evaporă brom sau iod, în special dacă acestea sunt încălzite. Evaporează și gheață. Dacă rufele ude să stea în frig, apa îngheață și apoi gheața se evaporă și se usucă lenjerie.
In evaporarea lichidelor care sunt răcite, ca fluid care părăsește molecula cea mai rapidă.
§ 6.2. Echilibrul între lichid și vapori
Starea cea mai interesantă a gazului - este saturat cu abur. El este în echilibru cu lichidul.
abur saturat
Cantitatea de lichid într-un vas deschis scade continuu prin evaporare. Dar, în cazul în care nava este închisă ermetic, atunci nu, care poate fi explicată după cum urmează.
Pentru prima dată, după ce vom turna lichidul în recipient și închideți-l, se evaporă lichid și densitatea de vapori a fluidului va crește. Cu toate acestea, în același timp, va crește și numărul de molecule, revenind rezultatul înapoi la mișcarea termică aleatoare într-un lichid. Cu cat mai mare densitate de vapori, cu atât mai mare numărul moleculelor sale înapoi într-un lichid. Într-un vas deschis imagine este diferită: molecula din stânga lichidul nu poate merge înapoi într-un lichid.
Într-un vas închis, în final, o stare de echilibru: numărul de molecule care părăsesc suprafața lichidului este egal cu numărul de molecule de vapori care se întorc în același timp, în lichid. Acest echilibru se numește dinamic sau în mișcare. În echilibrul dinamic între lichid și vaporii și evaporarea simultană a lichidului și condensarea aburului, și atât media de offset reciproc (fig. 6.2).
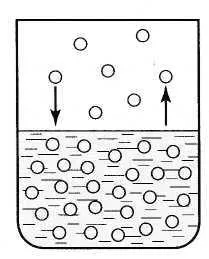
Steam, care este în echilibru dinamic cu lichidul său se numește abur saturat. Aceasta subliniază că, în acest volum, la această temperatură nu poate fi mai mare de vapori. Dacă aerul din vasul cu lichid este evacuat, apoi deasupra suprafeței lichidului va fi doar vaporii de saturație.
abur saturat la o temperatură dată are cel mai mare număr de molecule pe unitatea de volum (și, prin urmare, cea mai mare densitate), și are cea mai mare presiune.