ploaie acidă (6)
Intensificarea activităților umane în secolul trecut a dus la un dezechilibru semnificativ existent în natură, cauzând o mulțime de probleme legate de protecția mediului.
Printre foarte grave probleme de mediu cel mai mare plan de îngrijorare este creșterea poluării bazinului aerian al impurităților Pământului, care au origine antropică. aerul atmosferic este activitatea principală a mediului a biosferei, inclusiv oameni. Conform datelor preliminare emise în atmosferă anual sute de milioane de tone de oxizi de sulf, azot și alți compuși halogenați. Principalele surse de poluare a aerului sunt centralele electrice, care folosesc combustibili minerali, metalurgia feroasă și neferoase, industria chimică și petrochimică, aviație și transport auto.
Odată ajuns în atmosferă, de multe poluare suferă reacții chimice sau fotochimice care implică componente de aer. Produsele finale ale reacțiilor chimice sunt eliminate din precipitații atmosferice sau cad la suprafața pământului cu aerosoli. Obținerea pe suprafața obiectelor biologice, construcții și alte lucruri, impurităților și a produselor de conversie a acestora intensifica procesele fizico-chimice de distrugere a materialelor organice, metale și materiale anorganice.
Deteriorarea producției faunei sălbatice poluare și produse atmosferice activităților umane, este dificil de estimat, dar distrugerea pădurilor, poluarea bazinelor acvatice, răspândirea bolilor alergice, violarea echilibrului biologic în ecosisteme, nu în ultimul rând legate la concentrațiile ridicate de substanțe agresive în atmosferă.
ploaie acidă
Termenul „ploaie acidă“ se referă la toate tipurile de precipitații meteorologice - ploaie, zăpadă, grindină, ceață, ploaie și zăpadă, - din care pH-ul este mai mic decât pH-ul mediu al apei de ploaie (mediu de pH pentru apa de ploaie este egal cu 5,6). Eliberată în timpul activității umane a dioxidului de sulf (SO2) și oxizi de azot (NOx) sunt transformate în particule atmosferă pământ acidifiere. ( „Secolul XX :. Ultimii 10 ani.“ 91) Particulele reacționează cu apa atmosferică, transformând-o în soluții acide, care reduce pH-ul apei de ploaie. Pentru prima dată termenul de „ploi acide“ a fost introdus în 1872 de către exploratorul Engleză Angus Smith. Atenția lui a fost atrasă de smog victorian din Manchester. Desi oamenii de stiinta de la momentul respins teoria existenței ploii acide, astăzi nimeni nu se îndoiește că ploaia acidă este una din cauzele de deces al vieții în corpurile de apă, păduri, recolte și vegetație. De asemenea, ploile acide distruge clădiri și situri culturale, conducte, face mașini inutile, reduce fertilitatea solului și poate duce la scurgerea de metale toxice din acvifere de sol.
ploaie convențională Apa reprezintă, de asemenea, o soluție slab acidă. Acest lucru se datorează faptului că substanțele naturale ale atmosferei, cum ar fi dioxidul de carbon (CO2) intră în reacție cu apa de ploaie. Aceasta formează un acid carbonic slab (CO2 + H3O -> H3CO3). ( „Chemistry and Society,“ American Chemical Society. Pp. 423-424), în timp ce în mod ideal, pH-ul apei de ploaie este egal cu 5.6-5.7, în viața reală, aciditatea (pH) apei de ploaie într-o singură zonă poate fi diferită de indicele de aciditate a apei de ploaie în alte zone. Aceasta depinde în primul rând de compoziția gazelor din atmosfera unui anumit domeniu, cum ar fi oxizii de sulf și oxizi de azot.
In 1883, cercetator suedez Svante Arrhenius a intrat în tratament cu două termen - acid și bază. El a numit substante acizi care, atunci când dizolvați în ioni de hidrogen încărcați pozitiv în formă liberă de apă (H +). El a numit substanțe motiv că atunci când este dizolvat în formă liberă de apă ioni de hidroxid încărcați negativ (OH-). PH-ul termen este folosit ca un indicator al acidității apei. „PH Termenul înseamnă în limba engleză“ concentrația exponentului de ioni de hidrogen. „(Chimia și societate. Pp. 428)
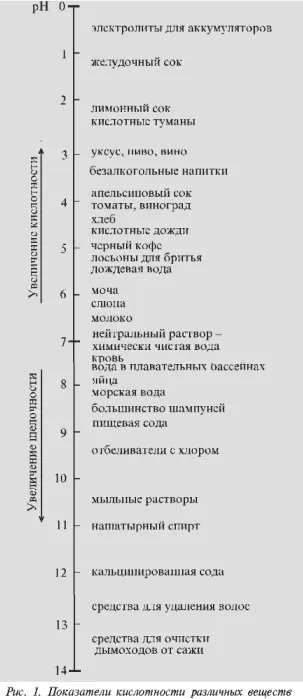
PH-ul este măsurat pe o scală de la 0 la R14 sunt prezente ca ioni de hidrogen (H +) și ioni de hidroxid (OH-) în apă și soluții apoase. Atunci când concentrația de ioni de hidrogen (H +) în apă sau într-o soluție egală cu concentrația de ioni de hidroxid (OH-) în aceeași soluție, o astfel de soluție este neutră. Soluția cu pH neutru egal cu 7 (pe o scară de la 0 la 14). După cum știți, când dizolvarea acidului în apă crește concentrația ionilor de hidrogen liberi (H +). Ei apoi ridica aciditatea apei sau, cu alte cuvinte, pH-ul apei. Astfel, odată cu creșterea concentrației ionilor de hidrogen (H +) scade concentrația de ioni de hidroxid (OH-). Aceste soluții, valoarea pH-ului la care scara redusă variază între 0 și 7 până la 14, numit de bază.
Ar trebui să acorde o atenție la o caracteristică a scalei pH-ului. Fiecare etapă ulterioară pe scara pH-ului indică o scădere de zece ori a concentrației ionilor de hidrogen (H +) (și în consecință aciditatea) în soluție și creșterea concentrației de ioni de hidroxid (OH-). De exemplu, aciditatea unei substanțe cu o valoare de pH 4 este de zece ori mai multe substanțe acide la valoarea pH-ului de 5, de o sută de ori mai mare decât aciditatea unei substanțe cu o valoare de pH6 și o sută de mii de ori mai mare decât aciditatea unei substanțe cu o valoare de pH9.
ploile acide este produs prin reacția dintre apă și poluanți, cum ar fi dioxidul de sulf (SO2) și diferiți oxizi de azot (NOx). Aceste substanțe sunt eliberate în atmosferă rutier, ca urmare a unor plante metalurgice și centrale electrice, precum și arderea cărbunelui și a lemnului. Reacționează cu apa atmosferic, acestea sunt transformate în soluții de acizi - sulfuric, sulfuros, azotos și azotic. Apoi, împreună cu zăpadă sau ploaie, ele cad la pământ.
Aciditatea soluției apoase este determinată de prezența în ea a ionilor pozitivi de hidrogen H + și se caracterizează prin concentrația acestor ioni într-un litru de soluție C (H +) (mol / l sau g / l). Alcalinitatea soluției apoase prin prezența ionilor hidroxil, OH- și caracterizat prin concentrarea C lor (OH -).
Calculele indică faptul că pentru soluții apoase ale produsului concentrațiilor molare ale ionilor de hidrogen și hidroxil - o valoare constantă egală cu
C (H +) C (OH -) = 10-14,
cu alte cuvinte, aciditatea și alcalinitatea sunt interdependente: creșterea acidității conduce la o scădere a alcalinitate, și vice-versa.
P
Rezultă că condiția pentru medii acide:
media alcaline:
În practică, gradul de aciditate (sau alcalinitate), exprimată în soluție mai convenabilă, cu pH, care este un logaritm negativ al concentrației molare a ionilor de hidrogen:
De exemplu, în cazul în care concentrația soluției de ioni de hidrogen este de 5,10 mol / l, valoarea de acid a soluției pH = 5. Această modificare unitate indicator aciditate de pH care corespunde unei modificări de zece ori a concentrației de ioni de hidrogen în soluție. Astfel, concentrația ionilor de hidrogen într-un mediu de pH = 2 până la 10, 100 și 1000 de ori mai mare decât într-un mediu cu un pH de 3, 4 și 5, respectiv.
În soluții acide de pH 7, și mai mare, cu atât mai mare alcalinitatea soluției.
gama de aciditate este de la pH = 0 (aciditate extrem de ridicată) prin pH 7 (neutru) până la pH = 14 (foarte mare alcalinitate).
Pur naturale, în special apa de ploaie, de apă, în absența poluanților are totuși o reacție ușor acidă (pH = 5,6), deoarece se dizolvă cu ușurință dioxid de carbon cu formarea acidului carbonic slab:
CO2 + H2O H2 CO3.
Pentru a determina valoarea acidă folosind diferite pH-metrului, dispozitive electronice deosebit de scumpe. Un mod simplu de a determina natura mediului este utilizarea de indicatori - substanțe chimice colorație care variază în funcție de pH-ul mediului. Cel mai frecvent indicator - fenolftaleină, metil oranj, turnesol, precum și coloranți naturali, varză roșie și coacăz negru.
Efectele ploii acide.
În 70-e. în râuri și lacuri din țările scandinave au început să dispară de pește, zăpadă în munți vopsite în culoarea gri, frunzele din copaci presărate prematur la sol. Foarte curând, aceleași fenomene observate în Statele Unite, Canada, Europa de Vest. În Germania a suferit 30% și, uneori, 50% din păduri. Și toate acestea se întâmplă departe de orașe și centre industriale-TION. Sa dovedit faptul că cauza tuturor acestor probleme - ploi acide.
PH-ul se schimbă în diferite corpuri de apă, ci gama neperturbat mediu pe termen natural al acestor modificări este sever limitată. Apele naturale și solurile au o capacitate de tampon, ei sunt capabili de a neutraliza o parte din acid și un mediu de co-magazin. Cu toate acestea, este evident faptul că capacitatea de tampon la tijele nu sunt nelimitate.
Iazurile afectate de ploile acide, o nouă viață poate inhala cantități mici de îngrășăminte fosfat; ele ajuta plancton absorb nitrați, reducând astfel aciditatea apei. Folosind fosfat mai ieftin decât var plus fosfat are un efect minim asupra chimiei apei.
Pământul și plantele, desigur, de asemenea, suferă de ploaie acidă Dei: reducerea productivității solului, furnizarea redus de substanțe tatelnyh pi modifica compoziția microorganismelor din sol.
daune enorme cauzate pădurilor tropicale acide. Uscarea-din pădure, se dezvoltă devitalizarea unor zone întinse. Acid crește mobilitatea din aluminiu de sol, care este toxic pentru rădăcini fine, iar acest lucru duce la oprimarea ramurilor fragile-foliare sti. Deosebit de afectate sunt conifere, deoarece acele sunt înlocuite mai des decât frunze, și, prin urmare, se acumulează mai mulți agenți de efectele nocive guvernamentale pentru aceeași perioadă. coniferelor rândul său, galben, ei izrezhivayutsya coroană, deteriorate rădăcini superficiale. Dar schimbarea culorii frunzelor, în cazul în care vărsat prematur din frunze guvernamentale de copaci, coroana mor parte este deteriorat scoarță de copac. reînnoire naturală picior cu păduri de conifere și foioase are loc.
Creșterea acide daune ploaie cauza culturi-agrico guvernamentale: acoperind țesuturile plantelor deteriorate, schimbă metabolismul celulelor, plantele încetini creșterea și dezvoltarea, reduce rezistența la boli și parazit-acolo, randamentele sunt în declin.
Universitatea de Stat din Carolina de Nord, experții americani au examinat efectele exercitate de acidul ploaie-mi pe plante în timpul perioadei lor de sensibilitate maximă la factorii de mediu. Sub influența ploilor acide nu în mod indirect, după cocean de porumb polenizare formirova cereale elani mai puțin decât în apele de irigație. Și mai mult, în apa de ploaie care conține acid, mai mici de cereale a fost format pe știulete. Cu toate acestea, sa dovedit că ploaia acidă, la polenizarea trecut, nici un efect marcat asupra formării boabelor.
Studii universitare de efectuat susceptibilitatea la ploi NYM 18 specii de culturi acide și 11 specii de plante ornamentale în stadii incipiente de creștere. Cea mai conjugată activitate-podver virusare erau frunze de tomate, soia, fasole, tutun, vinete, floarea-soarelui și bumbac. Cel mai puțin sensibil - grâu de toamnă, porumb, salată, lucernă și trifoi.
Ploile acide nu ucide numai animale sălbatice, dar, de asemenea, distruge monumente. Robust marmura, solid, un amestec de oxid de calciu (CaO și CO2), reacționează cu o soluție de acid clorhidric-Ser și transformat în gips (SaSO4). Temperaturile în schimbare, ploaie și vânt fluxurile de a distruge materialul moale. Povestiri-cal monumente din Grecia și Roma, în picioare timp de milenii, în anii sat-Lednev distruse chiar în fața ochilor noștri. Aceeași soartă amenință Taj Mahal - o capodoperă a arhitecturii indiene perioadă Mughals Veli-cal din Londra - Turnul din Londra și Westminster Abbey. În ST. Paul, Roma Portland strat de calcar erodat de 2,5 cm. În Țările de Jos, statui de pe ST. Ioan topi ca acadele. depozitele negre mâncată Palatul Regal pe Piața Dam din Amsterdam.
Mai mult de 100 de mii. Valoroase vitralii care împodobesc bisericile din cort, Konterberi, Köln, Erfurt, Praga, Berna, în alte orașe europene pot fi complet pierdut în următorii 15 până la 20 de ani.
După ce a studiat noi date privind aciditatea de precipitații în diferite regiuni ale Europei de Vest, precum și impactul acestora asupra ZDA-TION și facilități, personal, Universitatea din Dublin (Il-Land) a constatat că situația cea mai catastrofală este Moose în centrul Manchester (Marea Britanie), în cazul în care 20 luni de precipitare acidă s-a dizolvat 120 g per 1 m2 de piatră (gresii Single, marmura sau calcar).
Orașul a suferit foarte mult, deși cantitatea totală de precipitații în perioada observată de timp nu a fost extrem de scăzut. Evident, dar a fost un grad prea ridicat de aciditate.
Pentru Manchester ar trebui să Liphun (județul Hampshire Veli-Marea Britanie) și Antwerpen (Belgia), în care fiecare din piatra de aer din interior a pierdut 100 g de 1 m 2. Chiar și cunoscutele zagryaz atmosferă nennostyu-oraș, Atena, Copenhaga și Amster- doamnelor a suferit o degradare acidă în mult-Men mare măsură.
Suferă de ploi acide, iar oamenii care sunt forțați să consume apa contaminată cu metale toxice potabila - mercur, plumb, cadmiu, etc.
Salvați natura este necesară din acidifiere. Pentru acest Xia va reduce drastic emisiile de sulf și oxizi de azot, dar în primul rând de dioxid de sulf, așa cum este acidul sulfuric și sărurile sale, în 70-80% cauza ploaie aciditate, drop-ing la distanțe mari, din spațiul de emisie industriale.
Capac sistem de control al poluării de zăpadă este situat pe site-RII România efectuat pe 625 de puncte, să examineze o suprafață de 15 milioane de euro. km2. Probele prelevate în prezența ionilor de sulfat, azotat de amoniu, metale grele, determinat valoarea pH-ului.
precipitații naturale au aciditate diferite, dar media pH = 5,6. precipitare acidă cu pH1 2 Vezi toate