Oxid și hidroxid de calciu
Lecția dedicată studiului substanțelor care prezintă o mare valoare practică în viața umană, și anume, în acest domeniu al vieții sale, ca și construcție. Maestrul spune despre metodele de preparare, proprietăți și aplicații de oxid de calciu și hidroxid.
Subiect: Materiale și transformarea lor
oxid de Lecție și hidroxid de calciu. Proprietăți și aplicații
1. Metode de producere a oxidului de calciu
Chiar și în cele mai vechi timpuri oamenii au observat că, dacă arde calcar, cretă sau marmură, pulberea albă a fost obținută cu proprietăți speciale. Componenta principală a cretă, calcar și marmură este o substanță numită carbonat de calciu. Formula sa chimică - CaCO3. Când prăjire calcar are loc reacția, ecuația este:
CaCO3 = CaO + CO2

Fig. 1. Minerale, care se bazează pe carbonat de calciu
Oxidul de calciu poate fi obținut prin arderea directă a calciului într-o atmosferă de oxigen:
Când această reacție se produce compus de calciu cu oxigenul pentru a forma oxid de calciu.
2. istoric Oxidul numele și hidroxidul de calciu
Proprietățile oxidului de calciu rezultat este utilizat în construcția de până acum. Oxid de calciu - CaO este conexiunea nomenclaturi. În plus față de nomenclatura, această substanță are un număr de nume istorice. După cum știți deja, oxid de calciu poate fi obținut prin ardere de calcar, astfel încât unul dintre numele sale istorice - var ars.
În cazul în care oxidul de calciu rezultat, se adaugă apă, apa va șuiera, ca și cum străluceau. Prin urmare, varul ars este numit „nestins“. In contact cu apa oxidul de calciu este stins, dând căldură. De aceea, procesul care are loc numit călire, și oxid de calciu - var.
Formată în aburul de răcire slabeste var nestins, se acumulează ca puf. În acest sens, care rezultă în contact cu apa de var stins, a devenit cunoscut sub numele de puf.
3. Proprietățile de oxid de calciu
Ce se întâmplă când nestins de stingere? Este stabilit că o moleculă de oxid de calciu este reacționat cu o moleculă de apă se formează și numai o singură substanță nouă - var stins. Această reacție este un tip de conexiune.
CaO + H2O = Ca (OH) 2
Formula de var stins este scris de obicei după cum urmează: Ca (OH) 2. Nomenclatoarelor substanței - hidroxid de calciu:
4. Utilizând hidroxidul de oxid de calciu și în construcția
Amestecul de var stins și apă se numește mortar, care este utilizat în construcții. Deoarece hidroxidul de calciu este puțin solubil în apă, mortarul conține un precipitat de hidroxid de calciu și o soluție adecvată (apa de var).
Utilizarea mortarului în construcția unei pietre de conectare de durată datorită întărire în aer.
Astfel, întregul proces de fabricare și utilizarea oxidului de calciu poate fi reprezentat ca un circuit (Fig.2).
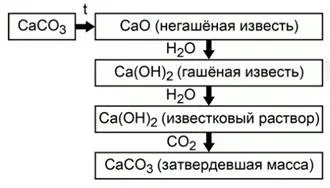
Fig. 2. Prepararea și aplicarea de oxid de calciu
Calcinarea de carbonat de calciu se formează var stins - oxid de calciu. Atunci când este amestecat cu apa oxidul de calciu este transformat în var stins - hidroxid de calciu. Un amestec de hidroxid de calciu greu solubil și apă se numește mortar. La repaus în suspensie de var aer reacționează cu dioxid de carbon și reconvertit într-carbonat de calciu.
Ecuația reacției, corespunzătoare procesului de solidificare a mortarului:
Ca (OH) 2 + CO2 = CaCO3 + H2O
Solidificarea mortarului se datorează faptului că substanța insolubilă format - carbonat de calciu.
Lista de lecturi
1. oxid și hidroxid de calciu.
2. chimie anorganică.
Se încarcă.
Trebuie să descărcați planurile de lecție pe hidroxid tema „oxid de calciu și. Proprietăți și aplicații. link-ul hold
Se încarcă.
lucrari populare
- Peisaje în versurile S.Pushkina
- Analiza Blok poem „în câmpul Kulikovom“
- Tată și fiu în poveste D. Aldridge "The Last Inch"
- Viața și opera lui Goethe VI
- Deciziile tribunalului de arbitraj. sarcini
- Proiectare de catering de proiectare restaurant. partea 2
- A. și S. S.Pushkin A.Esenin naturii Rusă
-
proiect Statistica