molecula de gaz Gram - știu cum
1. gram Dislocarea moleculei de gaz. legea lui Avogadro
moleculă Gram oricărei substanțe în stare solidă, lichidă sau gazoasă reprezintă o anumită cantitate de substanță. care deține o anumită cantitate de spațiu. Cu alte cuvinte, molecula de grame are nu numai greutatea, ci și volumul. Acest volum este destul de ușor de calculat, folosind formula
P = V · d
unde P - w, în acest caz, greutatea moli (M), alunițe de volum și gravitate trapezoidale d- și specifice, sau densitate. Pentru substanțele solide, se exprimă cantitatea în grame per 1 cm3 și gazoasă - în grame pe 1 litru. Pe baza acestei formule, se poate determina cu ușurință cantitatea de moli: V = M. d; M - ușor de învățat, se calculează greutatea moleculară a substanței. ad - cu ajutorul tabelelor de frecvență. Considerăm volumul în condiții normale (temperatură și presiune de 0 ° 760 mm Hg. V.).
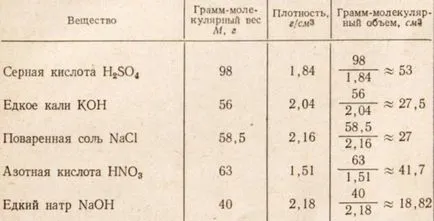
Tabel. 1 gram care molecula de fiecare dintre substanțele enumerate ia o cantitate diferită, deoarece mărimea fiecărei substanțe moleculare variază și numărul de molecule ale moleculei gram este aceeași.
Din tabelul de mai sus. 2 date arată că volumul gram molecular de gaz egale între ele gram-molecula de orice gaz în condiții normale, ocupă un volum de 22,4 litri.
• Înregistrați acest număr în carte și amintiți-vă bine.
Ce este explicat? Se pare că golurile dintre moleculele de gaz sunt atât de mari încât cantitatea de molecule în comparație cu aceste distanțe este neglijabil, și putem ignora. Astfel, prin măsurarea cantității măsurăm de fapt suma suma decalajelor dintre molecule.
Tabelul 1. Volumul Gram moleculare și densitatea lichidelor și solidelor
Tabelul 2. Volumul gram moleculare și densitatea gazului
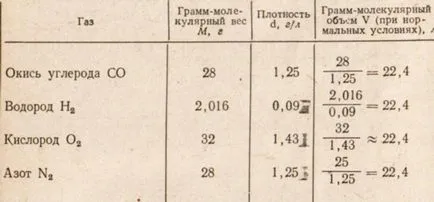
În ceea ce privește distanța dintre molecule, aceasta depinde de condițiile de temperatură și presiune (), și complet independente de natura gazului și dimensiunea sa moleculară, cu toate acestea, în aceleași condiții obținem același volum.
Aceasta sugerează următoarea concluzie: în aceleași condiții, în moli gazele ocupă volume egale.
• Înregistrați această concluzie într-un caiet.
Rezultatele obținute sunt în mod logic, ne conduc la următorul: ca în grame molecula de orice substanță conține același număr de molecule, iar gazele gram-molecula ocupa același volum în aceleași condiții, putem concluziona că: un volum egal de gaze în condiții identice, conține unul și același număr de molecule. Această concluzie a fost atins în 1811 de chimistul italian Avogadro așa-numita lege a lui Avogadro.
• Notați formularea legii în carte.
■ 1. Cum se calculează cantitatea de moli lichid solid? (A se vedea. Response)
2. De ce este volumul de gram-molecule de lichide și solide sunt diferite?
3. Ce este un „condiții normale“?
4. De ce este volumul de gaz gram-molecule în aceleași condiții sunt egale?
5. Care este cantitatea de moli de orice gaz în condiții normale?
6. După cum a formulat legea lui Avogadro. (A se vedea. Response)
2. Calculele privind formulele chimice care folosesc volume de moli de gaz
Știind că volumul gram-molecule de gaz în condiții identice, sunt ușor pentru a calcula volumul oricărei cantități de gaz este uneori mai importantă decât cunoașterea greutății sale.
■ 12. Cât H2 hidrogenul poate fi expulzat din acid clorhidric, 130 g de zinc (condiții normale)? (A se vedea. Response)
13. Care este cantitatea de acid clorhidric gazos obținut prin reacția HCI 67,2 L de H2 hidrogen cu clor Cl2 (condiții normale)?
14. Când recuperarea oxidului de cupru cu format hidrogen din cupru 8g. Care este suma cheltuită pentru reacția de hidrogen (condiții normale)?
15. H2S hidrogen sulfurat este ars conform ecuației:
2H2S + 3O2 = 2SO2 + 2H2O
Se calculează volumul de oxigen și dioxid de sulf, când au ars 5 moli de hidrogen sulfurat (condiții normale).
16. Care este cantitatea de dioxid de carbon consumat în reacție cu 37 g de hidroxid de calciu Ca (OH) 2, în cazul în care SaSO3 carbonat (condiții normale) este format prin reacția? (A se vedea. Response)
4. Densitatea gazului absolută și relativă. Determinarea greutății moleculare a gazelor în densitate absolută și relativă
Conceptul de densitate absolută și relativă a gazelor rezultă direct din materialul deja luate în considerare de către noi despre volumul de moli de gaz.
Densitatea absolută (sau greutatea specifică) a gazului - este greutatea de 1 litru de gaz. Sale ușor de identificat prin formula:
unde M - greutate gram moleculară a gazului și V - volumul de moli de gaz egal în condiții normale de 22,4 litri.
Prin urmare,
Cunoscând greutatea moleculară. Puteți găsi densitatea absolută. Pentru această formulă, dacă se cunoaște densitatea adevărată, poate determina greutatea moleculară cu formula M = 22,4m · d (condiții normale).
Densitatea relativă - este un număr abstract care indică de câte ori un gaz mai greu (sau brichetă) cealaltă (în condiții identice).
Care poate fi determinată prin compararea greutății de 1 litru de gaz (d 1) și 1 litru de alt gaz (d 2), m. E. Comparând densitatea absolută a acestor gaze.
densitatea relativă a formula ar arata ca raportul dintre densitatea absolută a gazului la densitatea absolută a unui alt gaz:
De fapt, densitatea relativă este raportul dintre greutățile moleculare ale celor două gaze. simbol chimic al gazului, care este comparat cu greutatea moleculară dorită a gazului este plasat chiar în partea de jos în desemnarea densității relative. De exemplu, dacă ai pus dH. Aceasta înseamnă că densitatea relativă arată de câte ori greutatea moleculară a gazului țintă asupra greutății moleculare a hidrogenului. Dacă există o dB, ceea ce înseamnă că greutatea moleculară dorită a gazului este comparat cu o greutate moleculară medie a aerului, care este egal cu 29 la. e.
Pe baza densității relative cu formula
puteți identifica oricare dintre cele trei variabile, dacă știi restul. De exemplu, este posibil să se găsească greutatea moleculară a gazului utilizând formula:
■ 17. Care este densitatea adevărată? (A se vedea. Response)
18. Cum putem determina greutatea moleculară folosind densitatea adevărată?
19. Care este densitatea relativă?
20. Derive formula densitate relativă.
21. Cum se determină greutatea moleculară a gazului, în cazul în care se cunoaște densitatea relativă? (A se vedea. Response)
5. Calcule bazate pe conceptele de densitate absolută și relativă a gazului. Determinarea greutății moleculare a gazului și cu formula
Dacă știm densitatea reală a gazului, cu formula de densitate absolută derivată de mai sus putem găsi cu ușurință greutatea sa moleculară.
Exemplul 5: Se determină câte ori mai grele decât aerul clor.
Soluție: Clor cu greutate moleculară de 35,5 · 2 = 71. Greutatea moleculară medie a aerului este de 29.
A: clor mai grei decât aerul de 2,4 ori.
■ 22. Se calculează greutatea moleculară a gazului, în cazul în care greutatea gazului este 1,696 g (A se vedea. Răspuns)
23. Formula de gaz, dacă se știe că adevărata densitate de 1,25 g / l și cu următoarea compoziție: carbon C ~ 43%, 57% oxigen ~ 0.
24. Formula de gaz, dacă este pentru densitatea de hidrogen este de 15, iar următoarea compoziție: 80% carbon, 20% hidrogen.
25. Care dintre următoarele gaze mai grele decât aerul: hidrogen sulfurat H2S, fluorul F2, CO2 dioxid de carbon, amoniac, NH3, Ar, Ar? (A se vedea. Response)