Modelul clasic al atomului Rutherford
Modelul atomului. 1903 de J .. J. Thomson, a propus un model al atomului, conform căruia atomul este o sferă uniform umplut cu electricitate pozitivă. Electronii sunt scufundate în acest mediu și să interacționeze cu elemente ale mediului în conformitate cu legea lui Coulomb (fig. 4.1, a). Conform acestui model, în general, atom neutru: încărcătura totală a sferei și încărcătura de electroni este zero. Spectrul atomului trebuia să fie dificil, dar în nici un caz un spectru linie, care a fost contrar datelor experimentale. Conform Thomson model de electroni oscilant (oscilator) poate emite unde electromagnetice. În cazul unui electron din poziția sa de echilibru, forțe care încearcă să-l revină la poziția sa de echilibru. Acest lucru creează oscilații ale electronului, care provoacă emisia unui atom.
Acesta a fost propus ca un model al atomului, prezentat în Fig. 4.1b. atom consta dintr-o sferă, centrul căruia a fost încărcat pozitiv nucleul și electronii sunt aranjate în jurul acestuia. Cu toate acestea, acest model nu a putut explica rezultatele experimentelor.
Cel mai faimos model de planetar al atomului propus de fizicianul englez E. Rutherford (fig. 4.1, c).
Experimente anterioare pentru a studia structura atomului a fost făcută
E. Rutherford și colaboratorii săi E.Marsdenom și H.Geygerom în 1909-1911 de ani. Rutherford a propus o sondă atom să se aplice prin # 945; particule care apar în timpul dezintegrării radioactive a radiu și unele
alte elemente. Aceste experimente au fost făcute posibile prin descoperirea de radioactivitate în care un rezultat al descompunerii naturale radioactive a elementelor grele -particles alocate având o sarcină pozitivă egală cu taxa de doi electroni -particle masa de 4 ori mai mare decât masa unui atom de hidrogen, adică ele sunt ionii de atom de heliu. Energia particulelor emise din diferite elemente chimice grele, variază de la uraniu eV eV pentru toriu. greutate # 945; particule de aproximativ 7300 de ori masa de electroni, și o sarcină pozitivă egală cu dublul taxei elementare. In aceste experimente am folosit # 945; -particles cu o energie cinetică de 5 MeV. care corespunde ratei de circa m / s.
Aceste particule sunt bombardați folie de metale grele (aur, argint, cupru, etc.). Electronii incluse în atomii nu se schimba traiectoria datorită masei reduse # 945; -particles. Dispersia, adică, schimbarea în direcția de deplasare # 945; Particulele pot provoca doar grele pozitiv încărcat o parte a atomului.
Scopul experimentelor lui Rutherford a fost de a testa experimental poziția de bază a modelului atom propus de Thompson.
Experiența de conducere de imprastiere Rutherford # 945; Particulele este prezentată în Fig. 4.2.
Aici K - container de plumb cu o substanță radioactivă, e - ecranul este acoperit cu sulfura de zinc, F - folie de aur, M - microscop. Dintr-o sursă radioactivă, un prizonier în container de plumb, # 945; -particles au fost direcționate către o folie subțire de metal. Grosimea foliei a fost m (1 micron), echivalentul a aproximativ 400 de straturi de atomi de aur. folie imprastiate # 945; -particles pe ecran acoperit cu un strat de cristale sulfura de zinc strălucire capabile sub lovituri de particule incarcate energetice. De scintilație (flash) pe ochi ecran văzut

observații împrăștiate # 945; particule în experimentul lui Rutherford ar putea fi realizată la diferite unghiuri # 966; la direcția inițială a fasciculului. Sa constatat că majoritatea # 945; Particulele trecut printr-un strat subțire de metal, testarea practic deviere. Cu toate acestea, o mică parte a particulelor este încă deviate prin unghiuri mari de peste 30 °. foarte rare # 945; -particles (aproximativ o zece mii) au fost testate pentru deflexie unghiuri de aproape 180 °. Acest rezultat a fost neașteptat, deoarece A fost în contradicție cu modelul budinca de prune, potrivit căreia sarcina pozitivă este distribuit în întregul volum al atomului. Cu o astfel de distribuție de sarcină pozitivă nu se poate crea un câmp electric puternic, capabil să picătură # 945; -particles în urmă. Câmpul electric este încărcat uniform pe suprafața sa castron maximă și scade la zero, așa cum se apropie de centrul bilei. Dacă raza sferei, care se concentrează toată sarcina pozitivă a atomului, a scăzut de n ori, forța de respingere maximă care acționează asupra # 945; -particle de legea lui Coulomb, ar fi crescut cu n 2 ori. Apoi, pentru valori suficient de mari ale lui n # 945; -particles ar putea fi împrăștiate prin unghiuri mari de până la 180 °. Aceste considerații au condus Rutherford ajuns la concluzia că atomul este aproape gol, și toată încărcătura pozitivă este concentrată într-un volum mic, care are dimensiuni de ordinul
10 -14 m. Această parte se numește atom atomnymyadrom Rutherford. Electronii conform Rutherford, care se deplasează în jurul nucleului cu dimensiunea de ordinul a 10 -14 m. Deci modelul atomic nuclear (Fig. 4.1 in).
Pe baza rezultatelor obținute, Rutherford, având în vedere că atomul, electronii nu pot afecta în mod semnificativ împrăștierea particulelor rapide și relativ grele, el a tras concluzii care au stat la baza modelelor planetare (nucleare) de atomi:
1) există un nucleu în care întreaga masă este atom și toată sarcina pozitivă este, în care dimensiunea kernel este mult mai mică decât dimensiunea atomului concentrat;
2) electroni, care fac parte din nucleele atomilor se mișcă în jurul orbite circulare.
Pornind de la aceste două ipoteze și presupunerea că interacțiunea dintre -particle incidentului și nucleul încărcat pozitiv este determinat de forțele Coulomb, Rutherford a constatat că nucleele atomice au dimensiuni m. I.E. acestea sunt doar mai puțin de dimensiuni atomice. Nucleul ocupă doar 10 la 12 din volumul total al atomului, dar conține toată sarcina pozitivă și cel puțin 99,95% din masa sa. Substanța care constituie nucleul unui atom are o densitate enormă # 961; ≈10 17 kg / m 3. Sarcina nucleului trebuie să fie egală cu sarcina totală a electronilor aparținând atomului. Ulterior, sa constatat că în cazul în care taxa de electroni este luat ca unitate, atunci taxa nucleară este exact egal cu numărul de elemente din tabelul periodic. Magnitudinea nucleului atomic Z sarcină electrică pozitivă determinată de numărul de protoni din nucleu (și, prin urmare, numărul de electroni din coji atomice), care coincide cu numărul de serie al elementului din tabelul periodic. Taxa este Ze. în cazul în care e = 1,602 x 10 -19 Cl - valoarea absolută a sarcinii electrice elementar. Taxa determină proprietățile chimice ale tuturor izotopii unui element dat.
În 1911, Rutherford, folosind legea lui Coulomb, a obținut o formulă
unde N - numărul # 945; particule care se încadrează pe unitatea de timp pe obiectiv; dN - cantitatea de împrăștiate pe unitatea de timp # 945; particule într-un unghi solid d # 937; unghi # 952; ; Ze și n - taxa de nuclee de difuzie și de concentrare a acestora; dx - grosimea stratului de folie; V și m # 945; viteza și masa # 945; particule.
experimente directe pentru a măsura taxa de nuclee pe baza formulei Rutherford Chadwick au fost efectuate în 1920 ani. Montajul experimental este prezentat în Fig Chadwick. 4.3.
Un difuzor inel (hașurată din fig. 4.3), amplasat coaxial cu și la distanțe egale între sursa și detectorul și # 945; Particulele D. La măsurarea cantității de împrăștiată dN # 945; particulele de port se închide ecran în inel, care a absorbit fasciculul directă # 945, particule de la sursa
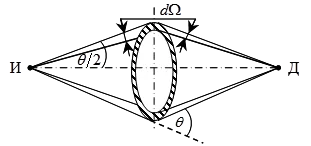
detector. Detector înregistrat numai # 945; -particles, dispersat într-un solid
Unghiul d # 937; unghi # 952; la fasciculul incident # 945; particule. Apoi inel ecran suprapus cu o gaură, iar densitatea de curent a fost măsurat # 945; particule la locația detectorului. Din datele obținute, numărul calculat N # 945; Particulele izbesc inelul la un moment dat. Astfel, dacă știm energia # 945; - particulele emise de sursa, valoarea determinată cu ușurință Z în formula (4.1).
Formula lui Rutherford este folosit pentru a explica rezultatele experimentale ale imprastiere # 945; particulele cu nuclee grele. ceea ce a dus la descoperirea nucleului atomic și crearea modelului nuclear al atomului.
Modelul atomic propus de Rutherford amintește sistemul solar. Acesta este motivul pentru care modelul este numit modelul planetar Rutherford al atomului. Acest model a fost un pas semnificativ spre conceptul modern al structurii atomului. Conceptul său de bază a nucleului atomic, care se concentrează toată sarcina pozitivă a atomului și aproape toate din masa sa, și-a păstrat valoarea sa până în prezent.
Cu toate acestea, spre deosebire de modelul planetar al sistemului solar, modelul planetar al atomului este auto-contradictorie din punctul de vedere al fizicii clasice. Acest lucru se datorează în primul rând prezența sarcina unui electron. Conform legilor electrodinamicii clasice, un electron filare în jurul nucleului, la fel ca orice particulă rapid se deplasează încărcat radiază unde electromagnetice. Spectrul aceste radiații trebuie să fie continuu, adică cuprind unde electromagnetice cu orice lungime de undă. Deja această concluzie este contrar spectrele de emisie linia de atomi observate experimental.
În plus, radiația continuă reduce energia cinetică a electronului. Prin urmare, din cauza este necesară radiația o rază în mișcare a orbitei de electroni să fie redusă, și, în cele din urmă, electronul trebuie să cadă în nucleu, conform estimărilor, în timp. Cu toate acestea, în realitate, atomul de hidrogen este stabil și „trăit lung“ sistem electromecanic. Cu alte cuvinte, modelul planetar al atomului din punctul de vedere al fizicii clasice este instabilă.