Miozina - l
Fig. molecule de miozină 1. Schema: 1-fibrillyarnyysterzhen; 2-cap.
Cap de pere în formă de: lungimea lor este de aprox. 20 nm, iar grosimea de 9,5 nm și 5.5 nm după un punct de atașare la porțiunea stem. Acesta din urmă este format din două lanțuri polipeptidice mol. m. cca. 200 mii. Fiecare (t. Chemat. Heavy lanț) răsucite elicoidal în jurul unul pe altul. În capetele cu lanțuri grele asociate subunitate a lanțului ușor având un molecular. m. cca. 20 mii.; pe cap cade două lanțuri ușoare. Mol. m. Întreaga moleculă este de aprox. 480000.
După clivarea M scurt de tripsină două fragmente formate, la- numite. HMM ușoare și grele (notat respectiv. LMM și HMM). LMM este o bucată a porțiunii tijei a moleculei M. aprox. 80 nm și un mol. m. 150 mii. M. HMM cuprinde o porțiune de cap și o lungime coada de 60-70 nm, mol. m. cca. 340000. Acțiunea papaină sau lung. expunerea la tripsina clivate din molecula M. capul (adică. se numește. subfragmente 1 sau S1 mol. m. până la 120 mii. Rod fragment HMM la-ing scindat prin acțiunea papaina numit. subfragment 2 (S2).
M. are activitate ATPase; catalizează hidroliza ATP la ADP și H 3 PO 4 (această comunicare deschisă M. V. A. Engelgardtom și M. N. Lyubimovoy 1939). Site-ul activ al M. ATPazei situat în cap și păstrează katalitich. Insulele de comunicare în proteolitich lor. clivaj. Esențial pentru activitate sunt e-amino grupe de lizină, arginină, grupări guanidine, grupări carboxil-glutamic și aspartic la-t.
Mușchii M. interacțiune. cu actina pentru a forma si la un m-lea și h și n o în o g m p l e c o, care joacă un rol important în mecanismul de contracție musculară. Centrul este responsabil pentru conexiunea cu actina, este de asemenea situate în cap. Conectează-te cu M în prezența actinei. ioni de Mg 2+ este însoțită de creșterea multiplă a activității ATPazei. La tărie ionică scăzută în prezență. ATP apare superprecipitation p-TION, rezultând într-un roi actomiozin compresele complexe și apă versiuni.
Una din DOS. St-MA-in capacitatea sa de tărie ionică scăzută pentru agregare pentru a forma filamente bine ordonate, similar cu un k-ryh prezentă în mușchi. Native filament M este o plantă fusiform, cu un diametru de cca. 15 nm și 1500 nm. Moleculele Cozile M. sunt ambalate în interiorul filamentului și un cap situat în afara sub forma unor proeminențe aranjate în mod regulat pe pansament stimul. In centrul filamentului al moleculei M. agregate de coadă, rezultând într-o zonă care nu acceptă capete. Pe ambele părți ale centrului filamentului al moleculei M. agregat polar (cap la coadă). Un filament conține 300-400 molecule M.
În mecanismul contracției musculare sunt importante două tropomyosin proteine și troponina. Mai întâi moleculă (mol. M. 67 th.) Este complet construit dintr-un-helix și este compus din fragmente de structură primare identice care conțin 42 de resturi de aminoacizi. Tropomyosin mediu fără sare polimerizeaza, formând o structură vâscoasă cu birefringență. În interacțiunea. cu F-actin-tropomyosin moleculă se potrivește în canelura formată de dublu helix actinei. molecula Troponina este un complex de trei proteine, -troponina T (mol. M. 37 th.), troponina I (mol. M. 25 th.) Și troponina C (mol. M. 20 th.). Troponinei I-inhibitor actomiozin activitate Mg-ATPase, troponina C este capabil de a lega ionii de Ca2 +. Troponina I se leaga de actina, troponină T cu tropo miozină.
Fibrele musculare construite din fibrile distanțate longitudinal diametru (myofibrils) aprox. 1000 nm, o să-ryh lumină alternativă și roțile de culoare închisă (respectiv A și I roți ;. Fig 2.). În mijlocul discului I este placa Z, la paradisul pătrunde în fiecare fibra musculara, miofibrilă care deține în fascicul și aranjarea poziției lor. Zona dintre două plăci adiacente Z (. Așa numita c o p la o m p e.) - myofibrils unitate funcțională. myofibrils interioare sunt două tipuri de filamente paralele orientate cu axa longitudinală a mușchiului, actină și miozină -filamenty.
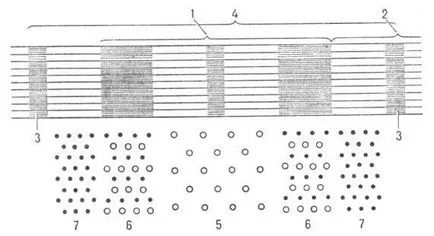
Fig. 2. Porțiunea de circuit myofibrils secțiune longitudinală (1 -disc A 2-drive I, 3-placă Z, 4-sarcomer); vnizupokazana Diagrama secțiunii transversale a myofibrils (miozină 5-tolkoniti, filamente 6-actină și filamentele de miozină numai 7-actină).
Contracția musculară apare ca rezultat al culisează filamente din filamente de actină M. (fig. 3), datorită periodicității. care unește capetele M. filamentelor de actină și îndoire molecule vym M în regiunea balama (există un „push“ de filamente de actină). Relaxarea apare ca rezultat al ruperii contactelor transversale M. și filamente de actină și de a reveni la poziția inițială.
Un astfel de ciclu este inițiată prin primirea unui semnal de la terminalele nervoase din fibra musculara la ING provoacă eliberarea de Ca2 + din sarkoplazmatich. reticulului (sistem complex de vezicule membranare delimitate si tubusoare m. numite. cisterne orientate de-a lungul myofibrils și penetrant fibrele musculare). Ca 2+ se leaga de troponină C, agregate cu actina și produce o schimbare în conformația proteinei. Ca rezultat, tropomyosin este mutat la o parte și nu împiedică formarea contactelor dintre capete și M. actinei. În cazul în care starea de conducere a capetelor, Ca 2+ -Mg 2+ ATPaza sarkoplazmatich. reticulum determină un flux invers în Ca 2+ internă. reticulului spațiu. Când concentrația de Ca2 + atinge un nivel suficient de scăzut, contactele dintre capete și M. actinei ruptura fibrelor musculare si relaxeaza. Energia necesară pentru acest proces vine ca urmare a ATP hidroliza M.
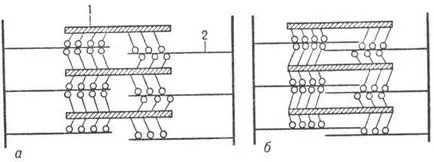
Fig. 3. Circuitul de mușchi striat în repaus (a) și în care reducerea acesteia (b); 1 - miozinei filamente; 2 - filamente de actină.
Lit:. Poglazov BF Levitskiy D. I. Myosin și mobilitatea biologică, M. 1982. BF Poglazov.
Chimice Enciclopedia. - M. sovietic Enciclopedia. Ed. I. L. Knunyantsa. 1988.