Locație 2 electroni atomului
electroni atomice muta la viteză mare în spațiul din jurul miezului. Este imposibil de spus în ce moment în acest spațiu este electronul la un moment dat. Se poate vorbi doar de probabilitatea de a găsi electronului la o anumita distanta de nucleu. Regiunea de spațiu în apropierea nucleului atomic, în care probabilitatea de a găsi un electron este cel mai mare se numește orbital (Fig.1.2).
distribuția de electroni secvențială în apropierea descrierii nucleului atomic este posibilă doar în cadrul mecanicii cuantice (Anexele 1 și 2).
În mecanica cuantică, probabilitatea de a găsi un electron la o anumită distanță de bază este definită de pătrat funcția de undă, care este o soluție din ecuațiile de bază ale mecanicii cuantice - ecuația Schrödinger. Se pare că această probabilitate, cu alte cuvinte, starea unui electron dintr-un atom este descris de patru numere cuantice: principal chislomn cuantice, chisloml cuantice orbitale, magnetice cuantice cuantice spin chisloms chislommi.
Principalul cuantic norului de electroni rezoluție chislonopredelyaet și caracterizează magnitudinea energiei de electroni. Atomul de hidrogen (Z = 1), de exemplu, sau în ionul de hidrogen cu taxa + Ze valoarea de bază a energiei electronilor este determinată de expresia:
M 'în cazul în care masa electronului, 0 - electric constant, - constanta lui Planck.
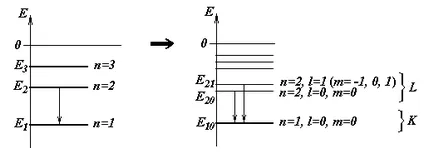
Numărul cuantic principal poate lua orice valoare întreagă pozitivă mai mare sau egal cu unu: n = 1, 2, 3, ... Astfel, energia unui electron dintr-un atom poate lua numai set discret de valori. fiecare dintre care corespunde opredelennomuenergeticheskomu atom nivel.
Cele mai mici electroni de energie au un prim nivel de energie (n = 1); acestea sunt cel mai puternic asociat cu kernel-ul. niveluri ulterioare Electronii sunt caracterizate printr-o marjă mare de energie. Un set de valori discrete ale atomic atom spectru nazyvayutenergeticheskim energie de electroni.
Forma chislolopisyvaet cuantică (simetrie) orbitali orbitale caracterizează atomic de electroni impulsul orbital de impuls:
Se poate lua valori întregi de la 0 la n-1: l = 0, 1, 2, ..., (n-1).
Astfel, electronii orbitali într-un moment de atom, precum și energia lor este cuantificată. adică poate lua un set discret de valori.
De obicei, pentru a indica stări de electroni care corespund diferitelor valori ale numărului cuantic orbital și orbitalii corespunzătoare utilizate litere mici ale alfabetului: s (l = 0), p (l = 1), d (l = 2), f (l = 3) și etc. (Formas - și p - orbitali este prezentată în Figura 1.2.) Literele s. p. d. f provin de aici, cu o serie de spectre ale metalelor alcaline: s - ascuțit (ascuțit), p - principal (principal), d - difuză (difuză), f - fundamentală (fundamentală). Literele care urmează f. du-te în ordine alfabetică.
Energia electronilor (1.1), un atom de hidrogen este independentă de valorile orbital numarul l cuantic. Cu alte cuvinte, spectrul energetic al electronilor în atom de hidrogen număr degenerate poorbitalnomukvantovomu. Cu toate acestea, degenerării este accidentală. Este caracteristic numai pentru interacțiunea potențială Coulomb a electronilor cu nucleul atomic și se numește degenerare Coulomb. In cazul atomilor multi-electroni sau de ioni, printr-o continuare reacționat cu un alt degenerări electron este îndepărtat. cu toate acestea, electronii cu diferite numere cuantice orbitale (.. s electroni și p electroni, etc.) au energii diferite: energia lor este cu atât mai mare cu atât mai znacheniel, mai precis, suma (n + l).