Lecture atom 2 ctroenie
atomi de structură. Formularea moderna a Legii periodic.
Descrierea cuantică a unui electron dintr-un atom
3 Formarea învelișului de electroni al atomului.
4 dimensiuni legi electroni de bază umple nivelurile, subnivele și orbitali în învelișul de electroni al atomului
5 E atomi de configurație și sistemului periodic.
atomi de structură. Formularea moderna a Legii periodic.
Descoperirea legii periodice a fost o condiție necesară pentru crearea secolului XX. teoria structurii atomice.
In 1911, Ernest Rutherford a propus modelul nuclear al atomului.
Conform acestui atom de model constă dintr-un nucleu încărcat pozitiv și nucleu care orbitează electroni încărcați negativ. Purtătorul de sarcina pozitivă a nucleului este un proton.
Compoziția include, de asemenea nuclee atomice neutroni - particule elementare. având în sarcină electrică.
Numărul de electroni egal cu sarcina nucleului. Un atom în ansamblu este electric neutru. Cel mai simplu nucleu este un nucleu al atomului de hidrogen. sarcina sa este 1, greutatea relativă - aproximativ 1 a. e. m. Nucleul atomului de hidrogen a fost numit proton *. taxa de protoni este egal în mărime și în semn opus la sarcina unui electron.
Dimensiunile sunt atom aproximativ 10-8sm. dimensiunea Kernel - aproximativ 10-13 10-12cm. În ciuda faptului că dimensiunea kernel-ului în zeci de mii de ori mai mici decât întregul atom, partea predominantă a masei atomului este concentrată în nucleu.
În 1913, fizicianul englez H. Moseley a constatat că taxa nucleară este numeric egal cu numărul de ordine al elementului în sistemul periodic.
Astfel, sarcina nucleelor atomice devin principala caracteristică a elementului chimic.
Prin urmare, formularea modernă a lotului-Kona -
Proprietățile elementelor și proprietățile ei formează substanțe simple și complexe depind periodic pe sarcina nucleele atomilor.
Studiile Moseley au confirmat corectitudinea locației în sistemul periodic al elementelor, care, bazate pe valorile maselor lor atomice, au fost „în afara poziției“: argon (Ar = 39.9), înainte de potasiu (Ar = 39,1), cobalt (Co = 58.9) la nichel (Ni = 58,7) și telur (Te = 127,6) la iod (i = 126,9). În conformitate cu magnitudinea miezului de încărcare-E, aceste elemente au fost plasate în sistemul Mendeleev corect.
Descrierea cuantică a unui electron dintr-un atom
In 1900 G. M. Plank pentru a explica comportamentul unui electron dintr-un atom cuantic sugerat ipoteza ca energia electronilor într-un atom poate emite sau absorbi numai anumite porțiuni - cuante.
In 1913, Niels Bohr a folosit teoria cuantică pentru a explica, din spectrul hidrogenului atomic pe presupunerea că electronii din atomii pot fi numai în anumite „permise“ orbite care îndeplinesc anumite valori energetice. Bohr a sugerat ca fiind în aceste orbite, electronul nu poate radia energie până atunci. în timp ce acesta nu va face trecerea de la o orbită la alta.
Teoria lui Bohr trebuie să calculeze cu exactitate spectrul de frecvență al atomului de hidrogen și celelalte sisteme one electron, adică. E. Ioni cum ar fi heliu, litiu, beriliu.
Cu toate acestea, trecerea la sisteme electronice mai complexe - multi electroni - teoria Bohr a fost insuficientă.
Nu a fost nevoie de o teorie mai generală, numită mecanica cuantică. O astfel de teorie descrie comportamentul unui electron dintr-un atom.
În anii 1923-1927 au fost formulate principiile de bază ale mecanicii cuantice.
Teoria cuantică are două dispoziții principale.
Un electron are o natură duală. Ea are proprietățile atât particulelor și valuri simultan.
Electron ca o particulă are o masă și sarcină. cu toate acestea, mișcarea de electroni - este un proces val. Electronii se-set fenomene de difracție caracteristice (acest lucru înseamnă că electronii pot curge în jurul valorii de obstacole).
poziția unui electron dintr-un atom este incert.
Acest lucru se traduce la chaet, este imposibil să se determine simultan și cu acuratețe viteza electronului și coordonatele în spațiu.
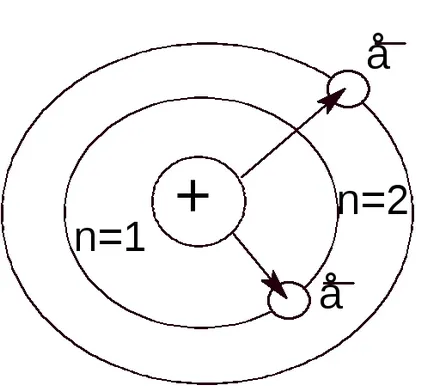
Electronic care se mișcă la viteze foarte mari, pot fi în orice parte a spațiului din jurul nucleului, și poziția formei sale instantanee diferită negativ-negativ-taxa așa-numitul nor sneravnomernoy moeelektronnoe densitate (Figura 3.1).
Forma și dimensiunea norului de electroni poate fi diferit în funcție de energia electronilor.
Pentru caracteristicile chimice ale elementului care este determinat de starea de electroni în învelișul de electroni al atomului este necesar să se cunoască:
- energia electronului în atom (mai precis, energia sistemului, co-statutul acestui electron, alți electroni și nucleu;
- forma datelor nor de electroni generat de electroni.

Stările de electroni din atom poate fi descris folosind patru numere cuantice: principale, orbitale și de spin magnetice.
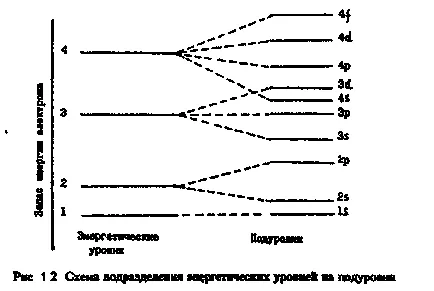
În funcție de energia electronilor din atom alocat nivelurilor și subnivele-cal energie Resurse de.
Numărul cuantic principal (n) reprezintă nivelul de energie și determină mărimea norului de electroni, t. E. Distanța medie a electronului din nucleu.
Numărul cuantic principal este un număr întreg 1, 2, 3. n, care corespund numărului de AEs energie urs.
Cea mai mare n este, cu atât energia electronilor, deci energia minimă corespunde primului nivel (n = 1). Valori mai mari ale lui n corespund valori mai mari ale energiei electronilor. Cu cât mai mare energia electronului, cu atât mai îndepărtată este din nucleu.
Valoarea mai mare a numărului cuantic principal corespunde la o dimensiune mai mare a norului de electroni. Electronii, care sunt caracterizate prin aceeași valoare a numărului cuantic principal n, norii de electroni formează aproximativ aceeași mărime.
Sau numărul cuantic orbital lateral (l)-Caracter zuet subnivel de energie determină forma de electroni-nor
Orbitalnoeilipobochnoe număr cuantic (l) este un număr întreg de la 0 până la (n - 1). Valoarea sa este de obicei denumită cifre și litere:
Numărul de valori posibile de l corespunde numărului de posibile subnivele la acest nivel egal cu numărul de nivel (n).
La 5,6,7 nivelurile de energie precum și 4 pot fi dispuse pe 32 electron (5S, 5p, 5d, 5f)
Legile de bază ale aprovozionare dimensiuni electroni nivelurile, subnivele și orbitali în învelișul de electroni al atomului
Completarea electroni nivel, subnivele și orbitali în învelișul de electroni al atomului-determinat prin următoarea dimensiune a legii:
I- Principiul energiei minime: starea de echilibru de electroni-tronuri sunt la cele mai mici niveluri de energie și subnivele.
Aceasta înseamnă că fiecare nou electron intră atomul la cea mai mică (în energie) subnivel liber. Pentru orbitalii de energie set goelektronnogo atomilor la nivelurile și modificările subnivele-Nyah după cum urmează: 1s <2 s <2р <З s <Зр <4 s <3d <4р <5 s <4d <5р <6s <4f ≈ 5d <6p <7s <5f ≈6d <7p .
secvență de orbitali atomici de umplere, în funcție de valorile principale și numerele cuantice orbitale determinate regulile Klechkovskii:
prin creșterea sarcina nucleului atomic umplere secvențială a orbitali atomici cu electroni din orbitalii are loc cu o cantitate mai mică magnitudine a principalului și a numerelor cuantice orbitale (n + l) la orbitali cu o valoare mare a acestei sume;
2) la valori identice ale sumei (n + l) orbitali de umplere are loc în direcția creșterii valorilor numărului cuantic principal n (Tabelul 1.2).
Tabelul 1.2 - Secvența de umplere a atomice
Astfel, deși elementele 3d-orbitale apar deja în a treia perioadă, 3d-orbitali umplere are loc numai după umplerea 4s-orbitali, adică elemente în a patra perioadă.
Principiul de excludere III- Pauli: un atom nu poate fi doi electroni cu aceleași valori ale celor patru numere cuantice.
Fiecare orbital - o stare de energie, care se caracterizează prin valorile a trei numere cuantice: n, liml. Aceste numere definesc dimensiunea, forma și orientarea spațiului orbital. Prin urmare, într-un orbital poate fi nu mai mult de doi electroni, iar acestea vor varia valoarea Th rotiri (centrifugare) Numărul cuantic: TS = +1/2 sau - 1/2
regula IV- Hund lui: numărul maxim de electroni umple orbitali disponibile, astfel încât numărul de electroni nepereche a fost mai mare în timpul formării de subnivele electronice.
Atom stare stabilă corespunde unei distribuții de electroni în interiorul subnivelul, în care valoarea absolută a spinului totală maximă (regula lui Hund). Prin urmare, atunci când se completează p-orbitali de atomi de carbon și azot, se umple fiecare electron orbitală liber, nu asociat cu un alt electron.
Structura învelișului de electroni al atomului și elementele de poziție ale ment sistemului periodic sunt interconectate. Cunoscând descompuneri de element din tabelul periodic, este posibil să se determine structura învelișului de electroni unui atom al oricărui element.
Numărul de ordine al elementului din tabelul periodic în încărcătura dovedește nucleu al atomului și numărul de electroni din atom.
Numărul perioadei corespunzătoare numărului de nivele de energie în învelișul de electroni al atomilor tuturor elementelor unei anumite perioade.
Numărul grupului corespunde în general cu numărul de electroni de valență în atomii elementelor din grup.
- electroni electroni de valență este ultimele nivele matic-energie. electronii de valenta au o energie maximă, și sunt implicate în formarea legăturilor chimice dintre atomii în molecule.
Atomii elementelor grupă principală (A) a tuturor electronilor de valență sunt la nivelul energetic trecut, iar numărul lor este egal cu numărul de grup.
Elementele laterale ale subgrupe atomi (B) în nivelul energetic final nahoditsyane a doi electroni,-oc tal electroni de valență sunt niveluri napredposlednemener energetic. Numărul total de electroni de valență, ca regulă, egal cu numărul de grup.
Numărul de niveluri de energie de electroni ocupate într-un număr de atomi corespunde perioadei în care elementul-ment: atomii elementelor I perioadă - nivel de o energie, în atomi perioadă II - doi, etc.
Cel mai mare număr de electroni la un nivel de energie egal cu:
unde n - numărul de nivel, sau numărul cuantic principal.
Prin urmare, primul nivel de energie poate fi nu locat-ditsya mai mult de doi electroni, al doilea - nu mai mult de 8, a treia -sa nu mai mult de 18, în a patra - nu mai mult de 32.
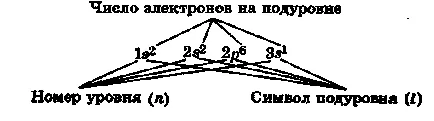
Acum, ia în considerare structura unui nivel de electroni singur. Pornind de la valoarea n = nivelurile de energie 2 juca rolul divid de substrate care diferă unul de altul datorită energiei nucleului. Numărul de sub-niveluri este egal cu numărul principal Kwan-tovogo, dar nu depășește patru.
H
Distribuția de electroni pe niveluri și subnivele (configurația elec tronic de atomi) este înregistrată ca formulele electron-TION.
De exemplu, formula e atomului de sodiu este scris ca:
Configurația electronică a atomilor și a sistemului periodic.
configurare atom electronic - distributia tuturor electronilor de atomi în nivelurile, subnivele și orbitali.
Există 2 moduri de a descrie configurația de electroni:
1 - formula electronica
2- configurație de electroni grafică.
Pentru starea tipic atomic sol (energie minimă) sau stare statică și o stare excitată.
Elemente ale primei perioade (H, He)
Numărul secvenței în elementul tabelul periodic ravenzaryadu nucleu atom Z și deci iobschemu numărul de electroni atomului.
Cel mai stabil (neexcitat) electron într-un stat atom corespunde cu valoarea minimă posibilă a energiei electronului.
Orice alt stat este excitat; de la ea merge în mod spontan în starea de electroni de energie mai mic.
In atomul de hidrogen neexcitat (Z = 1), numai electronul este la cel mai scăzut nivel de energie posibile: n = 1. În acest caz, numărul cuantic orbital poate avea doar o singură valoare l = 0. Astfel, primul nivel de energie este format numai s-orbital, și unde electronul.
Electron atom de hidrogen organigrame:
Electronic atom de hidrogen formula: 1s 1.
Atomului de heliu (Z = 2), al doilea electron este de asemenea situat pe 1s orbital. Formula electronică a unui atom de heliu: 1s 2.
Electron atom flowchart heliu:
Elemente de-a doua perioade (Li - Ne)
Urmându element de heliu - litiu (Z = 3) - al treilea electron nu poate sta în primul nivel de energie, ca și într-un orbital nu poate fi mai mult de doi electroni. Prin urmare, al treilea electron trebuie poziționat pe al doilea nivel de energie n = 2.
Când n = 2 numărul cuantic orbital poate lua două valori: l = 0; 1. orbitali Astfel, al doilea nivel de energie este format din două tipuri: unul s-orbital și trei p-Orbitali.