Emisiile și absorbția energiei de către atomi și molecule - studopediya
În 1913, Bohr a propus o teorie a emisiei de lumină, care se bazează pe două postulate:
1. Energia internă este atomi discrete, adică pot primi numai anumite valori permise sau niveluri care sunt multipli de cantitățile caracteristice pentru un anumit atom sau energia cuante. atom de Standing corespunzătoare acestor nivele de energie sunt staționare: în această stare, atomul emite unde electromagnetice, care apar în ciuda mișcarea electronilor în ea.
2. Emisia (sau absorbție) a radiației electromagnetice are loc în atom de tranziție de la o stare de echilibru în alta. Astfel emise (sau absorbită) radiație monocromatică cu o energie foton egal cu diferența dintre energiile Em și Ro a nivelelor de energie:
în cazul în care Em și En - sistem energetic în prima și a doua state, h - constanta lui Planck, n - frecvența radiat val ..
Pe baza acestor postulate Bohr a dezvoltat teoria radiației și absorbția energiei luminii unui atom de hidrogen. Se presupune că toate posibilele orbite de electroni efectuate numai acelea pentru care momentul cinetic (momentul cinetic) este egală cu un multiplu întreg al lui Planck împărțită la 2p:
Numărul n. Se numește numărul cuantic principal corespunde numărului orbity.v - electronul de viteză pe o orbită staționară.
În cazul atomului de hidrogen Coulomb forța de atracție a protonului și electronul este forța centripetă care deține electronii pe orbită, adică:
în care m și e - masa de electroni și încărcare, r - raza orbitei.
Eliminând v din (1.1) și (1.2), descoperim că raza orbitelor electronilor intr-un atom poate lua doar un număr de valori discrete:
(1), este substituit în (1.2) unde. (N = 1, 2, 3).
Astfel, razele orbitelor staționare ale atomului de hidrogen direct proporțională cu pătratul numărului cuantic n 2.
Pentru primele orbite principale n = 1 și rază.
Printre relațiile de mai sus și este viteza de electroni pe o orbită staționară. Pentru principalele orbite ale atomului de hidrogen (n = 1): 2,3 x 10 august cm / sec. Aceasta este ordinea de viteza orbitei de electroni.
Nivelul de energie al atomilor cauzat energia totală a electronului, care este compus din energia cinetică a electronilor (miez staționară) din energia electronilor și interacțiunea cu nucleul (energie potențială). Energia potențială a electronului (semnul este negativ ca energia potențială a forțelor de atracție) este egală cu:
Finalizarea energiei interne:
Astfel, energia electronilor asociată cu nucleul în atom, este negativ. energia electronilor liberi este egal cu zero.
Substituind valoarea expresie a vitezei de electroni, am găsit:
Următoarele valori sunt obținute pentru atom de hidrogen:
de bază de nivel (zero), n = 1, E1 = - 13,55 eV;
Schema nivelul de energie al atomului de hidrogen prezentat în Fig.

Fig. 1.1. Structura nivelurilor energetice ale atomului de hidrogen.
Deoarece nivelurile de energie sunt invers proporționale cu pătratul numărului cuantic n 2. diferența dintre fiecare două straturi adiacente ca numărul și scade valoare absolută. Astfel, distanța față de diferența dintre nucleu două nivele energetice adiacente de atomi scade:
cel mai scăzut nivel de energie regulată este numită primară, aceasta corespunde stării atomului, a fost supus nici influențe externe. Nivelurile staționare rămase sunt numite excitat.
atom Excitație, adică transferul de electroni pe orbita rază mai mare (Fig. 1.1. Junction 1) necesită mesaje atom energie suplimentară și, prin urmare, să apară ca urmare a unor influențe externe, precum coliziunea particulelor într-un proces de mișcare termice intensive sau o descărcare electrică în gazele, după absorbția unui foton de radiație electromagnetică, ca rezultat al recombinării ionilor de gaz sau de electroni și găuri în semiconductoare, atunci când este expusă la radiație particule atom, etc. Starea excitată este instabilă după aproximativ 10 -8 întoarce sec electron la orbita principal, fotonul emis suflare energie suplimentară obținută în urma excitării și atomul se duce la starea solului (Fig.1.1. 2 tranziție).
Un electron poate merge înapoi la orbita principală nu numai o singură schimbare, dar, de asemenea, pașii prin niveluri intermediare. În acest caz, tranziția va fi mai mulți fotoni emisi (Fig. 1.1. 3 schimburi) cu frecvențe care corespund diferenței de energie dintre aceste niveluri.
Teoria lui Bohr a explicat în serie spectru modele de atomi de hidrogen și atomi de hidrogen. La acea vreme, teoria a fost un triumf pentru dezvoltarea fizicii nucleare. Cu toate acestea, această teorie nu explică diferențele intensitățile liniilor spectrale, nu a dezvăluit legile atomilor mai complexe. Principalul dezavantaj al teoriei - inconsistența. Acesta combină situația fundamental diferite teorii clasice și cuantice. Astfel, în conformitate cu teoria de electroni se deplasează într-o orbită circulară în jurul nucleului, care corespunde conceptele fizicii clasice. Mai târziu, teoria lui Bohr a fost înlocuită cu mecanica cuantică.
Dependența de energie radiată de atomi sau molecule de pe lungimea de undă sau frecvența undei de lumină se numește spectrul de emisie. și absorbită - spectrul de absorbție. Intensitatea liniilor spectrale determinate de numărul de tranziții identice care apar pe unitatea de timp, și, prin urmare, depinde de numărul de emițătoare (absorbante) atomi și probabilitatea de tranziție corespunzătoare.
Spectrele atomice numite ca spectrele de emisie și spectre de absorbție care apar la tranzițiile dintre nivelele cuantice ale atomilor liberi sau slab interacționează. Spectrele atomice sunt conduși.
Sub spectrele atomice optice înțeles de către cei care sunt cauzate de tranziții între nivelurile de electroni exterioare din energia fotonilor de ordinul mai multor electron-volți. Aceasta include UV, spectrul vizibil și IR apropiat (microni). Spectrul de emisie al atomului de hidrogen sunt mai multe serii. Fiecare serie corespunde tranzițiilor de la diferite niveluri la același capăt.
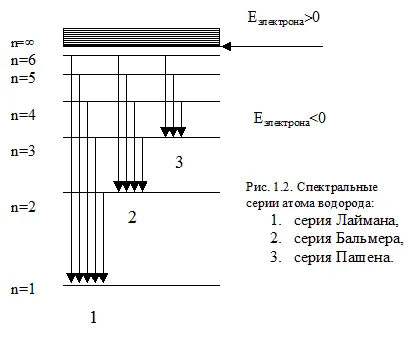
Liniile spectrale (frecvențe) din aceste serii pot fi calculate cu ajutorul formulei:
seria Lyman situate în regiunea ultravioletă și este format prin tranzițiile de electroni de la nivelurile de energie mai ridicate (ni = 2, 3, 4 ...) la nivelul zero (n = 1).
seria Balmer se află în regiunile ultraviolete vizibile și în apropiere, și seria Paschen - în regiunea infraroșu.
Structura nivelelor energetice ale atomilor complexe complicate despicarea nivelelor electronice, în funcție de interacțiunea dintre electroni și nucleu. Spectrele acestor atomi în dungi.
1.2. Concepte de bază ale teoriei cuantice.
În poziția modernă teoria cuantică a unui electron din atomul nu este asociat cu nici o orbită, t. E. Nu stabili poziția exactă a electronilor în volumul atomului, și luând în considerare probabilitatea de a găsi un electron la o dimensiune la fața locului dat. Încărcătura de electroni este distribuit pe întreg atomului, formând un nor de electroni de densitate variabilă. Densitatea norului de electroni în orice punct al atomului de volum corespunde probabilitatea de a găsi un electron în acest moment.
În mecanica cuantică, starea de mișcare a electronilor dintr-un atom este caracterizat prin faptul că nu unul, ci patru numere cuantice:
- Principalul cuantic Numărul n are numai valori întregi de la 1 la infinit.
- Side (sau orbital) numarul cuantic l ia valori de la 0 la (n-1) (valori totale n).
- Magnetic cuantic Numărul ml este un număr întreg de la -l la + l, inclusiv 0 (valori totale (2l + 1)).
- Spin număr ms cuantice poate avea doar două valori pe jumătate întregi: + ½ și -½.
Numerele cuantice determină stările posibile de energie ale electronilor în atom. Fiecare electron se caracterizează printr-un anumit set de numere cuantice. Colecția de electroni, caracterizat printr-un număr cuantic principal al nivelului de energie al formelor de atom. Distribuția electronilor în atomul nivelelor energetice se realizează pe baza:
- Principiul Pauli. Atomul poate fi electroni, caracterizate prin același set de numere cuantice.
- Principiul energiei minime. Distribuția electronilor în atom corespunde cu energia minimă a atomului.