Determinarea echivalentului electrochimică a cuprului
Activitatea de laborator №14
Obiectiv: aflați cum se determină empiric echivalentul electrochimic al cuprului.
Teorie: Procesul prin care moleculele de săruri, acizi și baze, atunci când este dizolvat în apă sau alți solvenți se vor dizolva particule incarcate (ioni) se numește disociere electrolitica; în care soluția rezultată cu ioni pozitivi și negativi, numit electrolit. Dacă vasul este plasat cu plăcile de electrolit (electrozi) conectate la bornele, o sursă de curent (a crea un câmp electric în electrolit), ionii încărcați pozitiv se va deplasa spre catod, în timp ce negativ la anod. La electrozii are loc reacțiile de oxidare-reducere, în care electrozii sunt alocate produse substanță de reacție.
Pentru electrolizei legea lui Faraday este valabilă: masa de substanță eliberată la electrodul este direct proporțională cu Q încărcare a trecut prin electrolit: m = QK sau m = IKT, în care K- electrochimice cantitate echivalentă de substanțe extrase în timpul trecerii electrolitului printr-o singură electricitate pandantiv. Pentru fiecare substanță valoarea K- este constantă. Prin măsurarea curentului din circuitul compus conform schemei pe măsură ce trece și masa eliberată la materialul catodic poate determina echivalentul electrochimic. De la Faraday lege 1 Kx (m) = Mm / A (kg / kl)
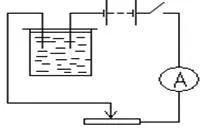
Echipament: 1. o sursă de energie electrică (soare redresor - baterie reîncărcabilă sau 4-12; 2. placa de cupru (2 buc), 3. o baie electrolitică cu o soluție de sulfat de cupru 4. ampermetru 5. Tasta 6. conectarea firelor; 7. Scala și. greutăți; 8. reostatul; 9. ore; 10. ventilator sau sobă de masă; 11. șmirghel.
1) suprafață purificată temeinic a unui șmirghel placă de cupru cântărit pe scala cât mai exact posibil.
2) Asamblați circuitul electric așa cum se arată în Fig. O placă ponderată conectat la polul negativ al unei surse de energie electrică.
3) După verificarea profesorul de lanț observat în timp ce pe ceas cu o mâna a doua, pentru a închide cheia. Rapid set reostat amperaj 1-1,5 A. Folosind un reostat, pentru a menține puterea de curent constant pe tot parcursul experimentului.
4) După 8-10 minute de circuit deschis. Placa servește experimentul catodică, îndepărtat, se spală ușor cu apă, se usucă înainte sau ventilator plăci și cântărite cu grijă pentru a determina greutatea cuprului precipitat.
5) Rezultatele măsurătorilor pentru determinarea echivalentului electrochimică a cuprului.
6) compară valoarea obținută cupru electrochimică echivalent și tabelate pentru a determina eroarea de măsurare relativă.
7) Rezultatele măsurătorilor sunt scrise în tabel.
masa catod la opytamK kg
masa catod după opytaMMK kg
kx = mM / A = 2 x 10 -3 / 0,7 x 900 = 3,174 x 10 -7 kg / C
= 3,174 x 10-7 -3294 × 10 -7 / 3.294 * 10 -7 x 100% = 3,6%
1) sare De ce molecula de acid alcalin în apă și se disociază în ioni?
2) De ce este o creștere a temperaturii electrolitului rezistență scade?
3) Va fi disociere electrică în spațiu de zbor?
4) În ce condiții concentrația electrolitului în procesul de electroliză nu se schimbă?
5) Ce ar trebui să fac în cazul în care, din greșeală, atunci când experiența de cântărire plăcii, catodul este conectat la polul pozitiv al unei surse de curent?
6) Cum se face atunci când este necesar pentru a lipi firul electrodului de carbon?
Răspunsuri la întrebările testului.
1) Deoarece molecula de apă este un dipol și se poate întinde ionii acestor substanțe.
2) Rezistența electrolit scade odată cu creșterea temperaturii, deoarece viteza crescută a ionilor, purtătorii de sarcină majoritate în electroliți.
3) Da, disocierea electrolitică în timpul zborului spațiu are loc.
4) Cu condiția ca anodul să fie eliberat în aceeași soluție de metal la fel de mult ca și depozitat pe catod și gaz nu este eliberată în timpul electrolizei.
5) Este necesar din greutatea inițială a anodului scade greutatea sa după disocierea electrochimice. Deci, puteți afla cât de mult de cupru este plecat de la placa într-o soluție, iar această masă egală cu masa depusă pe cupru catod.
6) Folosind disocierea electrochimică depus pe un electrod de cărbune, care - fie un metal, și apoi să lipire sârmă la acesta.
Concluzie: Am învățat de experiență pentru a determina echivalentul electrochimic al cuprului.