Cum de a salva fizica uimitoare energie electrică
Cum de a economisi energie electrică?
Este posibil să „reînvie“ bateria epuizată? Unii meșteșugari știu cum se face: prin bateria uscată epuizat este trecut curent impulsuri speciale. Această operațiune, uneori, de a face de mai multe ori. Cu toate acestea, ea restabilește pe scurt elementul.
Stai, stai! Orice ar fi fost, se pare că o celulă galvanică - aceeași baterie! Încărcarea șocul electric, restabilirea, vom acumula energie în el, care poate cheltui apoi. Este adevărat?
Se pare că sau nu. În primul rând, nu fiecare element poate fi reîncărcat. Este imposibil de a face acest lucru, de exemplu, cu un element în care există două electrolit lichid. Un exemplu este Daniel elementul, în care două lichide diferite separate printr-o cupă poroasă. Treptat curgând prin sticla, electrolitii se amestecă, reacționează unul cu celălalt și să emită curent. Acest element, în cazul în care acesta este deja împlinit termenul său, nu și-a revenit.
Alte elemente cu electrozi solide de reîncărcare, stoca energie în principiu, dar procesul de acumulare, astfel nerentabilă și ineficientă, că mulți consideră că este inutil. Acumulând doar o parte neglijabilă din energia electrică furnizată elementului și elementul în sine, după mai multe astfel distruse încărcări. Pentru a deveni o unitate de bun, o celulă galvanică ar trebui să fie suficient de bun pentru a efectua procesul de încărcare. Acest lucru în cele din urmă a reușit, în mijlocul secolului al XIX-lea.
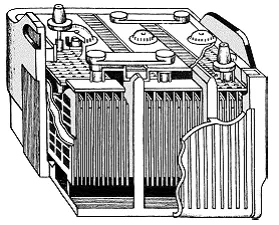
În 1859, om de știință și inginer francez Gaston Plante a petrecut o experiență interesantă, exterior foarte asemănătoare cu experiența Volta. Ca Volta, construit Plante celule electrochimice, cu toate acestea, așa cum a luat două plăci de electrozi de plumb, în condiții normale, acoperite cu o peliculă de oxid de plumb. Electrolitul a fost același - acid sulfuric diluat. Plante conectat la electrozii din sursa de curent constant și de ceva timp a trecut un curent prin elementul său, la fel ca atunci când reîncărcare celulele uscate. Apoi a oprit curentul și conectat la electrozii unui galvanometru. Aparatul a arătat că elementul PLANTE a devenit el însuși a genera curent electric, și, astfel, individualizata aproape toată energia cheltuită pentru exerciții. poate fi repetată de încărcare un număr mare de ori - întotdeauna un element lucrat bine, nu a distrus, cum ar fi bateriile uscate.
Această celulă electrochimică a fost numit element al doilea tip, sau o baterie. Pe măsură ce energia se acumulează în bateria Plante? Când un curent este trecut prin electrolit de acid sulfuric la o placă de plumb conectat la polul negativ al sursei de alimentare - catod, hidrogenul este eliberat, ceea ce reface oxidul de plumb în plumb pur. Electrodul conectat la polul pozitiv - anod, oxigenul este eliberat, care oxidează oxidul de plumb la peroxid. Bateria este încărcată când catod va conduce în întregime pură, iar anod - peroxid de plumb. Apoi va cea mai mare tensiune între electrozi.
Conectarea conductorului placă de electrozi cu puterea cheltuielilor de consum, vom descărca bateria. Direcția actuală atunci când evacuarea opusul a ceea ce a fost în timpul încărcării. Pozitiv placa încărcată se va recupera hidrogen și negativ - oxidabile cu oxigen. După ce plăcile vor fi la fel, bateria se oprește curentul dătător. Este necesar să se repete exercițiile.
Este clar că energia din baterie este stocată sub forma unei substanțe corporale - plumb, fier cu eliberarea de energie în peroxid de plumb. Chiar procesul de acumulare de energie și de eliberare se întâmplă aici în mod diferit decât în baterii pur electrice - condensatori. Prin urmare, o astfel de baterie se numește electrochimica.