compus clor oxigen
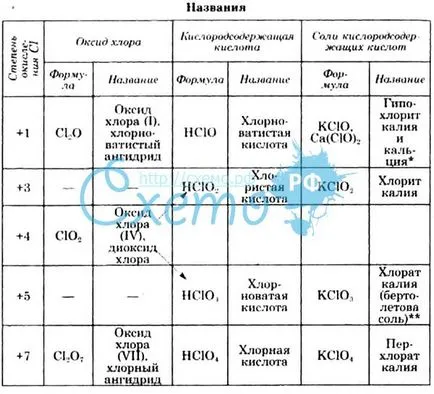
Clor se obține 4 oxiacizilor: clorură de hlornotistuyu, și percloric de clor.
Acid Hlornotistaya (HClO) este format prin reacția clorului cu apă, și sărurile sale cu acizi minerali puternici. Aparține acizilor slabi, este foarte instabil. Compoziția produselor de reacție ale descompunerii acesteia depinde de condițiile. Când puternic acidă ușor hipocloros, în prezența unei soluții de agent reducător și prelungit în picioare pentru a elibera ea se descompune oxigen atomic:
În prezența agenților de deshidratare format oxid de clor (I):
La Cl2 anhidrida poate fi considerată ca acid hipocloros. Când este încălzit, acidul hipocloros se descompune pentru a forma 2-Acid - acid clorhidric și cloric:
3 HClO + HCI = 2 NSlO3.
Prin urmare, atunci când interacțiunea clorului cu soluția alcalină fierbinte nu este formată sare clorhidric și hipocloros și acid clorhidric și acizi de clor:
Sărurile acidului hipocloros - hipoclorații - oxidanți foarte puternic. Ele sunt formate prin reacția clorului cu alcalii în frig. Simultan săruri formate cu acid clorhidric. Din aceste amestecuri cel mai des utilizat inalbitor si a apei zhavelevoy.
acidul cloric (NSlO3) este format sub acțiunea sărurilor sale - clorați - Acid sulfuric. Acest acid este foarte instabil oxidant, foarte puternic. Acesta poate exista doar în soluții diluate.
Soluție de evaporare NSlO3 la temperatură joasă, sub vid, se poate obține o soluție vâscoasă care conține acid percloric 40%. La conținutul de acid superior al soluției se descompune cu explozie.
Descompunerea cu explozie are loc la o concentrație mai mică în prezența unor agenți de reducere. În soluții diluate de acid cloric prezintă proprietăți oxidative și reacțiile continua destul de ușor:
sare a acidului cloric format în timpul electroliza soluțiilor de cloruri în absența unei diafragme între spațiile anozilor și catozilor, și, de asemenea, atunci când este dizolvat clor în soluție fierbinte alcalină, așa cum se arată mai sus. Format prin electroliza clorat de potasiu (bertoletova sare) puțin solubilă în apă și un precipitat alb este ușor separat de alte săruri. Ca acid cloratul - o destul de puternic agenți de oxidare:
Clorati sunt utilizate pentru producerea de explozivi, precum și pentru producerea de oxigen in saruri in vitro si acid percloric - perclorați. După încălzirea clorat de potasiu, în prezența dioxidului de mangan (MnO2), care joacă rolul unui catalizator, oxigenul este eliberat. Dacă căldura de clorat de potasiu, fără catalizator, se descompune pentru a forma săruri de potasiu ale acidului clorhidric și percloric:
Când perclorați de prelucrare de acid acid sulfuric concentrat percloric, poate fi preparat:
Acesta este cel mai puternic acid. Este cel mai stabil dintre toți acizii conțin oxigen de clor, cu toate acestea, acid anhidru sub încălzire, agitare sau în contact cu agenți de reducere pot fi descompuse cu explozie. Soluțiile diluate de acid cloric este destul de stabil și sigur în funcționare. clorat de potasiu, rubidiu, cesiu, amoniu, baze organice și mai puțin solubile în apă.
In industrie, perclorat de potasiu a fost preparat prin oxidarea electrolitică a clorat de potasiu:
2 H + + 2 e - = H 2 ↑ (catod);
SlO3 - - 2 e - + H2O = SlO4 - + 2 H + (anod).
Acid cloros (NSlO2) format prin acțiunea acidului sulfuric concentrat, clorită metalelor alcaline, care sunt obținuți ca intermediari în electroliza soluțiilor de clorură alcaline, în absența unei diafragme între spațiile anozilor și catozilor. Acesta este un acid slab, instabil este oxidant foarte puternic în condiții acide. Prin reacția cu acid clorhidric de clor eliberat:
clorit de sodiu este utilizat pentru producerea de dioxid de clor pentru dezinfectarea apei, precum și ca agent de albire.
Percloric sau pulbere de albire, var (SaOSl2) sau CaCl (ClO), formate prin reacția clorului cu hidroxid de calciu sub formă de pulbere - Pushenko:
Sub influența gazului dioxid de carbon conținut în aer, se descompune pentru a elibera clor:
Bleach este folosit ca un înălbitor și dezinfectant.